| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Маркерный хроматографический анализ в токсикологической химии
Аннотация В настоящей работе критически проанализированы существующие концепции системного подхода к решению проблем хроматографического определения новых метаболитов психоактивных веществ в биологических объектах и выявления фальсификатов алкоголя. На основании выбора характерных маркеров предложены новые подходы к применению методов хромато-масс-спектрометрического анализа для решения экспертных задач идентификации новых метаболитов, установления подлинности исследуемых спиртсодержащих образцов, способов их производства, установления общности происхождения исследуемых объектов или их принадлежности их к единой массе (совокупности). Ключевые слова хромато-масс-спектрометрический анализ, наркотики, пищевые продукты, спиртные напитки, подлинность образцов, аналитические методы К числу аналитических методов, наиболее широко используемых для контроля качества пищевых продуктов, относится газовая хроматография с масс-спектрометрическим детектированием. Идентификация подлинности различного рода продукции и определение ксенобиотиков в биологических объектах являются близкими задачами, поскольку основываются на аналитическом определении набора примесных компонентов, определяющих свойства и/или происхождение объекта исследования. Наряду с контролем качества пищевых продуктов, существует ряд сходных проблем из различных отраслей человеческой деятельности, для решения которых можно применить близкие методические подходы с целью доказательства принадлежности объекта к определенной общности (группе), основанные на выявлении хроматографических маркеров специфичности этой общности объектов. К числу примеров подобных задач можно отнести установление способа производства алкогольных напитков и идентификации их фальсификатов, а также подлинности лекарственных препаратов. С учётом общемировой тенденции к росту числа фальсификатов наиболее популярной и востребованной продукции, решение подобных задач стало особенно актуальным для современной аналитической химии. При наличии большого числа аналитических лабораторий, призванных решать подобные задачи, вторым важным моментом является необходимость развития методических подходов, позволяющих унифицировать и автоматизировать собственно хромато-масс-спектрометрический анализ, и создать единый методический регламент, призванный повысить межлабораторную воспроизводимость получаемой аналитической информации. Целью работы была разработка общих методических подходов для контроля качества алкогольной и фармацевтической продукции на принципах хроматографических методов анализа. Литературный поиск показал, что по маркерному анализу алкоголя работ крайне немного. В основном это описание методик технологического контроля спиртных напитков. Маркерному анализу наркотических веществ посвящены методики Комитета по контролю наркотиков ООН по установлению принадлежности образцов героина к единой массе и работы по идентификации источников нефтяных загрязнений. Общий подход к анализу спиртсодержащих жидкостей, наркотических веществ дан на схеме 1. Этот подход заключается в следующем. При исследовании спиртных напитков на подлинность система компонентов, характерных для подлинного образца, определяется как набор и соотношение большого количества летучих веществ составляющих букет, маркеров возраста и сопутствующих соединений. Ароматизаторы, разбавители и другие, посторонние для подлинного образца вещества, также являются системой компонентов, указывающих на фальсификацию. Идентификация таких систем компонентов позволяет надежно выявлять суррогатный алкоголь и в первую очередь коньяки и вина. При выявлении суррогатов спиртов-ректификатов и водок установление природы спирта проводили по набору минорных примесных веществ, которые ранжировали по идентификационной значимости. Аналогичный подход по поиску и проверке устойчивости признаков применяли при выявлении новых метаболитов лекарственных препаратов, которые необходимо отличать от компонентов биологической матрицы и продуктов деградации известных исходного вещества и его известных метаболитов. Еще одной проблемой, решаемой в этой работе, является выявление, разделение и систематизация хроматографических наложений. Практика показала, что хроматографические наложения появляются (даже в несложных органических матрицах) уже тогда, когда количество определяемых компонентов достигает 20-ти. Несмотря на возможность хромато-масс-спектрометрии детектировать до нескольких веществ в одном хроматографическом пике, селективности этого метода не всегда хватает даже при использовании наиболее современных систем автоматической обработки масс-спектров. Это приводит к получению ложноотрицательных результатов и требует применения предложенных в этой работе подходов: процедуры проверки результатов автоматической идентификации или альтернативных методов хроматографического разделения. Схема 1. Общий подход к анализу спиртсодержащих жидкостей, наркотических веществ и нефтяных загрязнений 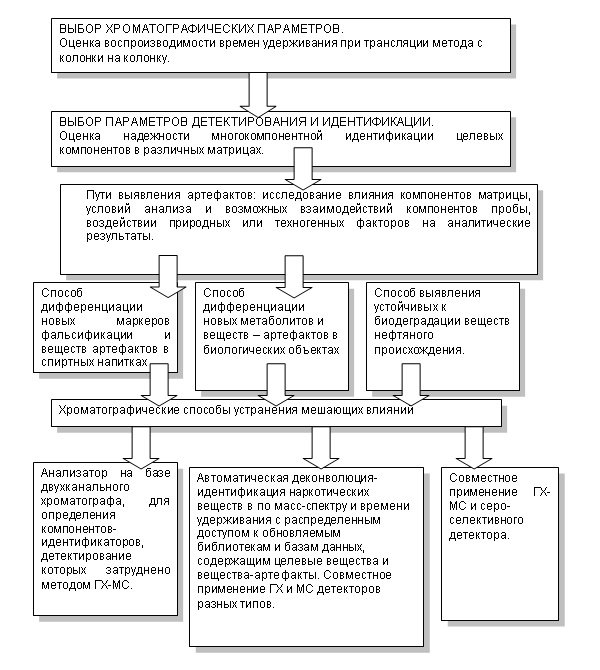 Методы хромато-масс-спектрометрического анализа в химико-токсикологическом исследовании спиртов и летучих ядов [9-21, 51-66] Выявление и устранение артефактов и хроматографических наложений. Для анализа спиртсодержащих жидкостей использовали следующую температурную программу: 75°C(1 мин), 10°C/мин, 190°C(60 мин), деление потока 1/12-1/16. Выявлен ряд хроматографических наложений (для фазы FFAP), способных искажать результаты идентификации природы спирта. Это следующие вещества (в скобках даны характерные ионы при совместном определении): ацетон/метилацетат (m/z58/74); бензальдегид/октанол-1 (m/z105/83); этиленгликоль/этилдеканоат/масляная кислота (m/z62/88/60); метанол/трет-бутанол/метилэтилкетон (m/z31/59/72); кротоновый альдегид/толуол (m/z70/91); пропионовая кислота/2,3-бутиленгликоль/3,7-диметил-1,3,7-октатриен (m/z74/90/136); 1.1-диэтоксиэтан/этилацетат(m/z103/88); бутилацетат/1,2-дихлорэтан (m/z73/63), акролеин/метилацеталь (1,1-диэтоксиметан) (m/z56/103), лимонен/диэтилкротональ/ изоамиловый спирт (m/z136/101/70), диэтилфталат/моноэтилсукцинат, этанол/бензол. Для разделения совместно элюирующихся компонентов нами предложен двухканальный хроматограф. Двухканальный хроматограф для выявления фальсифицированного алкоголя и определения летучих ядов в биологических объектах [8]. При ГХ-МС анализе алкоголя на колонке FFAP не удается разделить идентификационно значимую пару веществ изопропанол/этанол. Разделению этих компонентов мешает вакуум на выходе из колонки, приводящий к уширению пика этанола. Наиболее эффективно удается разделить этанол и изопропанол в спирте при ДИП детектировании. Как показано выше, пламенно-ионизационный детектор неспецифичен и не позволяет определять коэлюирующиеся компоненты, однако это возможно на колонке PORA PLOT Q. Наличие сахара в десертных спиртных напитках не позволяет корректно определять в них состав летучих веществ. Однако, летучие вещества на фоне сахаров возможно корректно определять методом парофазного анализа без термостатирования. Для решения перечисленных выше проблем разработана хроматографическая система, включающая следующие компоненты: Хроматограф с двумя узлами ввода, двумя пламенно-ионизационными детекторами и масс-спектрометрическим детектором. Каждый узел ввода оснащен автоинжектором с возможностью использования газоплотного шприца и шприца для ввода жидких проб. Канал 1: Колонка HP-FFAP подключена к масс-спектрометрическому детектору. Канал 2: Колонка HP-FFAP и колонка Pora PLOT Q, подключенные к одному инжектору через кварцевый тройник. Каждая из колонок подключена к пламенно-ионизационному детектору. Нами изучено формирование артефактов и исследование изменения состава градуировочных смесей летучих веществ при хранении. При анализе спиртов и спиртных напитков (коньяков и водок) обнаруживали соединения и группы соединений, не характерные для исследуемых образцов. Часто эти соединения идентифицировали в напитках низкого качества, что могло быть поводом к их использованию в качестве маркеров непищевого или низкокачественного спирта. Для этого необходимо было выяснить, могли ли быть эти соединения артефактами – продуктами распада лабильных компонентов пробы или они могли образоваться при хранении образца. Для этого исследования использовали многокомпонентные смеси летучих кислот, фурановых соединений. Эти образцы хранили при комнатной температуре, и в течение нескольких лет фиксировали изменение их состава. Для исследования деградации сахаров в инжекторе хроматографа анализировали 40%-е водно-спиртовые настои огурца, арбуза, смеси с лактозой, сахарозой и фруктозой, используемые как компоненты рецептур при производстве водок и коньяков. Результаты представлены в табл.1. Наиболее лабильным соединением был кротоновый альдегид, который по нашим данным, трансформируется в диэтилкротональ при хранении. Таблица 1. Вещества-артефакты, образующиеся при хранении и анализе спиртных напитков и стандартных смесей
Пример хроматографической дифференциации объектов по примесному составу. Различение синтетического спирта и спиртов биохимического происхождения. Синтетический спирт не разрешен к применению в пищевых и медицинских целях и внесен в Списки сильнодействующих и ядовитых веществ Постоянного комитета по контролю наркотиков. Синтетический этиловый спирт получают гидратацией этилена из попутных нефтяных газов. При синтезе образуется набор примесных компонентов (см. Табл. 2). Сравнивая набор примесных компонентов синтетического спирта и спиртов, полученных с применением технологии ферментативного брожения (см. табл.3), можно видеть существенную разницу в компонентном составе этих объектов, что и явилось основой методики. Следует отметить, что предложенная методика не позволяет различить пищевой и гидролизный спирт, поскольку примесные соединения в этих спиртах идентичны и формируются в процессе ферментативного брожения. Наиболее сложной задачей является выявление синтетического спирта-ректификата, который содержит ограниченный набор примесных соединений в следовых концентрациях. Для решения этой задачи было исследовано более 300 образцов, из которых была сформирована база ГХ-МС данных и коллекция спиртов различного происхождения. Критерии выбора и условия детектирования веществ-маркеров синтетического спирта-ректификата. Для целей идентификации синтетического спирта-ректификата наиболее пригодны такие примесные вещества, которые присутствуют в синтетическом спирте сырце в значительном количестве, являются нехарактерными для ферментных спиртов и трудно удаляются ректификацией и не образуются в спирте или спиртном напитке при длительном хранении. Совокупность идентификационных признаков дана в Табл. 2. Таблица 2. Содержания (мг/л) летучих компонентов синтетических спиртов и спиртов ферментного брожения из зернового и виноградного сырья
Оценка результатов идентификации. Спирт-сырец может быть признан синтетическим, если его примесный состав соответствует составу, приведенному в Табл. 1 и 2. Вещества, характерные для синтетического спирта ранжировали по идентификационной значимости (см. Табл. 2) и делили на четыре группы по убыванию вклада в результат идентификации. При исследовании спирта-ректификата образец может быть идентифицирован как синтетический спирт, если он имеет признаки 1 или 2 группы и не менее двух признаков 3 группы. Наличие в образце веществ, отнесенных к признакам 4 группы, не противоречит природе синтетического спирта. Ярким примером признака 4 группы может служить ацетон, по наличию которого этиловый спирт часто ошибочно идентифицируют (согласно ГОСТ), как имеющий непищевую природу. В некоторых спиртах-сырцах из зернового сырья наблюдали лимонен, стирол и вещества пиразинового ряда (2,6-диметилпиразин и 2,3-диметилпиразина, 2-этил-6-метилпиразин, 2-этил-5-метилпиразин, триметилпиразин, 2,6-диэтилпиразин). Эти вещества могут рассматриваться как маркеры нарушения технологии производства спирта. Таблица 3. Пример ранжирования признаков по идентификационной значимости. Маркеры синтетического спирта ректификата
Факторы, приводящие к ошибочной идентификации этилового спирта, как имеющего непищевую природу. Образование и накопление ацетона и сопутствующих веществ в водке при длительной выдержке. По существующей практике спирт или водка признаются произведенными из непищевого сырья при обнаружении в них следов ацетона (см. ГОСТ Р 51786-2001). Нами было проведено исследование изменения компонентного состава водки при ее длительной выдержке. После анализа образец водки, произведенный из пищевого спирта, не содержащего ацетон, выдерживали длительное время в герметично упакованной стандартной бутылке. Повторный анализ, проведенный через 2 года, показал образование значительного количества ацетона длительного хранения. Этот результат был подтвержден анализом многих образцов водки после длительного хранения. Можно предположить, что одним из возможных путей образования ацетона может быть окисление изопропанола, которого содержится в водках от 1 до 6 мг/л. Окислителем может служить кислород, растворенный в водной фракции водки. Этот факт не позволяет использовать ацетон как основной маркер природы спирта, поскольку есть вероятность его образования в любых этиловых спиртах. Часто в водках обнаруживают до 8-10 мг/л ацетона, что нельзя объяснить только окислением изопропанола. Поэтому, другим важным источником ацетона в водке может служить деградация сахаров – компонентов рецептур при длительном хранении образца (см. Табл. 1). В наибольшей степени к образованию ацетона склонны водки, содержащие инвертный сахар (данные С.Б. Максимовой). Химический состав и токсичность образцов нелегальной алкогольной продукции. Нами проведено исследование химического состава и токсичности образцов суррогатной водки из двух регионов (Тыва и Ставропольский край), самогонов (более 80 образцов из 4-х регионов России), а также образцы этанолсодержащих технических жидкостей. Исследования токсических свойств самогонов проводили на лабораторных животных и использовали биологические экспресс-тесты. Показано, что токсическими свойствами обладают отходы ликероводочной промышленности – денатураты (эфиральдегидные фракции и кубовые остатки ректификации – концентраты сивушных масел). Большинство исследованных нами образцов суррогатов алкоголя из незаконного оборота имеют токсичность сравнимую с токсичностью контрольных образцов, при этом их органолептические свойства, как правило, отрицательны или их токсичность обусловлена веществами неалкогольной природы (этиленгликоль, диэтиленгликоль, метанол, 1,2-дихлорэтан). Полученные результаты позволили сделать вывод о том, что причиной высокой алкогольной смертности в России является не повышенная токсичность суррогатов алкоголя, а негативные социальные факторы, провоцирующие увеличение потребления алкоголя [3]. Проблема выбора и идентификации денатурирующих добавок к этиловому спирту. Диэтилфталат, наряду с диэтиловым эфиром и кротоновым альдегидом, применялся для денатурации спиртов. Однако диэтилфталат является распространенным компонентом антропогенного в том числе и лабораторного загрязнения, а также легко удаляется ректификацией из этанола. Для дифференциации диэтилфталата, как денатурирующего агента и источника «лабораторного» загрязнения, предложена методика, базирующаяся на дифференциации устойчивого фонового распределения эфиров фталевой кислоты (диизобутилфталата, дибутилфталата, диизооктилфталата) и профилей спиртных напитков содержащих диэтилфталат как денатурирующую добавку. Так, если диэтилфталат обнаруживается в образце в отсутствие других эфиров фталевой кислоты, можно говорить об идентификации его как денатурирующей добавки, в случае, если его концентрация минимальна, по сравнению с другими гомологами, он является компонентом лабораторного или техногенного зпагрчязнения. По нашему мнению, для денатурации можно использовать выявленные нами устойчивые маркеры синтетического спирта (см. Табл. 3.). Идентификация подлинности коньяков и коньячных спиртов Эволюция летучих соединений в коньячных спиртах при выдержке и маркеры нарушения технологии коньячного производства. При выдержке молодых коньячных спиртов состав летучих соединений меняется. В спиртах происходит накопление уксусной кислоты от 35-50 мг/л до 150-450 мг/л, которая частично переходит в этилацетат, наблюдается образование эфиров других летучих кислот, ацеталей, что положительно сказывается на органолептических свойствах коньячного спирта. Аналогичные процессы происходят при изготовлении молодого коньячного спирта из некачественного (скисшего или окисленного) виноматериала. При этом процессы этерификации принимают неконтролируемый характер и органолептические свойства такого напитка отрицательны. Такие образцы обычно разбавляют водно-спиртовой смесью, для устранения негативного влияния этилацетата и уксусной кислоты и добавляют ароматизаторы, что является наиболее распространенными разновидностями фальсификации. Содержания компонентов коньячных спиртов типичные для отечественных коньяков приведены в Табл. 2. Пример хроматограмм некачественных коньяков приведен на рис.1.
Рис.1. Хроматограммы (ДИП) некачественных коньяков. 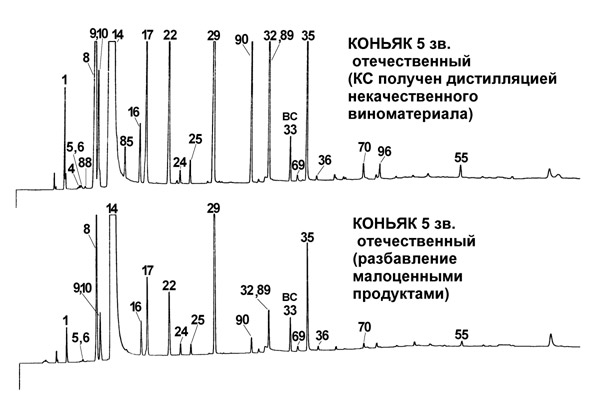 1 –ацетальдегид, 3 – метилформиат, 4 – ацетон, 5 – этилформиат, 6 – метилацетат, 8 – этилацетат, 9 – метанол, 10 – метилэтилкетон, 14 – этанол, 16 – втор-бутанол, 17 – пропанол-1, 22 – изобутанол, 24 – изоамилацетат, 25 – бутанол-1, 29 – изоамиловый спирт, , 32 – гексанол-1, 33 – циклогексанол – внутренний стандарт, 35 – уксусная кислота, 36 – фурфурол, 55 – фенилэтиловый спирт, 69 – этилоктаноат, 85 – диацетил, 89 – этиллактат, 90 – ацетоин, 96 – 1,2-пропиленгликоль. На верхней хроматограмме идентифицированы компоненты-признаки окисленного коньячного спирта: диацетил, ацетоин в концентрации 25 и 280 мг/л, соответственно, а также 1,2-пропиленгликоль – признак добавления ароматизатора. На нижней хроматограмме наблюдается занижение концентраций всех летучих компонентов в 2.5-3 раза по сравнению с типичными для отечественных коньяков, что свидетельствует о разбавлении образца водноспиртовой смесью. Критерии оценки качества спиртных напитков по составу летучих компонентов. Развитие нежелательных процессов, отрицательно влияющих на органолептические свойства, оценивали по содержанию следующих компонентов: 1. Процессы скисания виноматериала выявляли по повышенному содержанию уксусной кислоты (выше 700 мг/л и сопутствующих ей этиловых эфиров, прежде всего этилацетата (порок вин и коньяков «штих»). 2. Преобладание яблочно-молочного брожения над спиртовым оценивали по содержанию этиллактата (в качественных коньяках 50-200 мг/л). 3. Окислительные процессы контролировали по содержанию в пробах промежуточных продуктов метаболизма дрожжей – диацетила и ацетоина. С уровня концентраций 15-20 мг/л присутствие этих веществ сопровождается появлением в аромате ацетоновых тонов. 4. Качество виноматериала оценивали по содержанию втор-бутанола. Наличие втор-бутанола в коньячных спиртах и коньяках (более 15 мг/л) обычно связывают с микробиальной порчей сырья (виноматериала). 5. Наличие в коньяке цис-3-гексенола в содержании более 10 мг/приводит к появлению травянистых тонов в аромате и вкусе, наличие аллилового спирта в концентрации выше 3 мг/л вызывает горечь и жгучесть. 6. Разбавление коньячного спирта водноспиртовой смесью мы выявляли по пропорциональному снижению (против контрольных или типичных значений) концентраций высших спиртов как наиболее устойчивых к окислительным и этерифицирующим процессам. 7. Выявление ароматизаторов мы проводили по наличию 1,2-пропиленгликоля и бензилового спирта, глицерина, триацетина. Методика определения состава компонентов древесины дуба в коньяках и коньячных спиртах методом хромато-масс-спектрометрии. Разделение проводили на капиллярной колонке НР-5MS длиной 30 м, внутр. диаметром 0,25 мм, толщина пленки НФ 0,25 мкм. Температурная программа: 70 (1мин), 10°C/мин, 280°C (15мин). Количественный анализ проводили по выбранным ионам: m/z 152, 151, 178, 181, 182, 99, 164, 88,73. 213 и 59. В качестве внутреннего стандарта использовали о-ванилин концентрацией 2 мг/л. Подготовка пробы для анализа. В виалу вместимостью 2 мл вносили 1660 мкл образца, 50 мкл внутреннего стандарта и 280 мкл бутилацетата. Экстракцию проводили в виале, анализировали верхний органический слой. Критерии оценки качества коньяков и коньячных спиртов по составу компонентов древесины дуба (маркеров возраста). Продукты этанолиза древесины дуба (ванилин, сиреневый альдегид и другие) накапливаются в коньячном спирте при его выдержке в определенных типичных соотношениях. Отсутствие в образце каких либо маркеров возраста (или изменение их соотношений) позволяет предположить добавление ароматизатора. Наиболее простой и часто встречающийся случай фальсификации возраста: добавление ванилина в коньячный спирт, при этом сиреневый альдегид и другие компоненты отсутствуют. Анализ образцов коньяка с негативными органолептическими признаками – «можжевеловыми» тонами показал, что эти образцы содержат завышенное (примерно в 150-200 раз против типичного) содержание эвгенола, что свидетельствует об использовании сырой древесины для выдержки. Одним из наиболее значимых признаков подлинность при ГХ-МС анализе являются цис- и транс- ?-метил-?-окталактоны (МО-лактоны) – летучие вещества древесины дуба. Полное отсутствие МО-лактонов отмечали в образцах сделанных на основе ароматизаторов. Завышенные содержания МО-лактонов наблюдали в коньяках изготовленных по «ускоренной» технологии выдержки (см. Рис. 2). Рис. 2. Фрагменты хроматограмм по выбранным ионам экстракта коньяка и коньячного спирта. 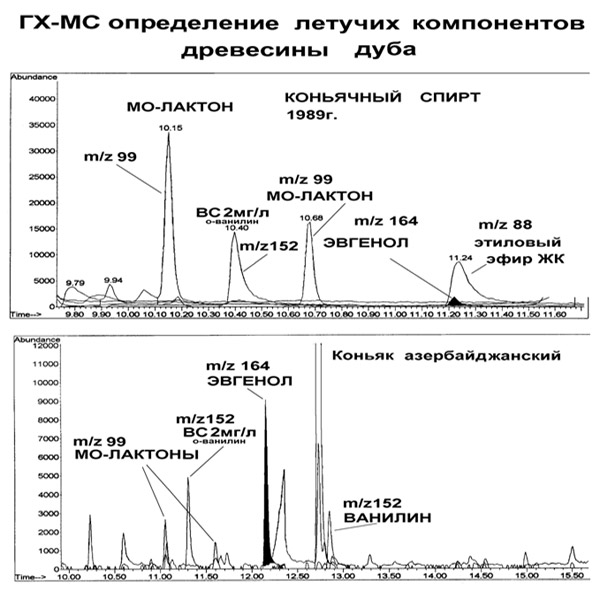 Методы хромато-масс-спектрометрического анализа в химико-токсикологическом исследовании наркотических и сильнодействующих средств [22-50, 67-69] Предлагаемый нами методический подход [7-9] базируется на сумме двух известных принципов. Принцип первый – трансляция абсолютных фиксированных (по внутреннему стандарту) времен удерживания. В газовой хроматографии метод трансляции фиксированных времен удерживания предложен фирмой Agilent (Hewlett Packard) в середине 90-х годов ХХ века. Перенос фиксированных времен удерживания выполняют для однотипных колонок при одинаковой температурной программе, что позволяет получить относительные и абсолютные фиксированные времена удерживания большого количества соединений с точностью не хуже 1% (+/-0.05 мин). В антидопинговом анализе при замене колонки абсолютные времена удерживания получают без анализа веществ сравнения по времени удерживания внутреннего стандарта, что регламентируется документами ВАДА, при этом погрешность трансляции должна быть не хуже 0.2 мин (WADA Technical Document TD2003IDCR). Обычно трансляцию выполняют таким образом, чтобы абсолютное время удерживания было в пределах «окна» поиска. Принцип второй – эффективный способ обработки масс-спектрометрических данных. «Система автоматической масс-спектрометрической деконволюции и идентификации» (AMDIS, Automated Deconvolution and Identification System), разработанная в институте NIST (США) в середине 90-х годов ХХ века. Методы, базирующиеся на принципе деконволюции ГХ-МС данных, наиболее эффективны и являются основной тенденцией автоматической идентификации. Под деконволюцией понимают интегрированный набор процедур получения чистых спектров индивидуальных соединений при обработке ГХ-МС данных. Опознавание («восприятие») вещества происходит по совпадению максимумов и характера кривизны пиков ионных хроматограмм, экстрагируемых из полного ионного тока. Нами предложен подход, объединяющий методы трансляция времен удерживания и автоматической деконволюции. Для этого были разработаны библиотеки масс-спектров с временами удерживания, что позволило создать унифицированный метод автоматической идентификации с возможностью непрерывного обновления версий и применить его в системе химико-токсикологических лабораторий. Первые результаты, полученные нами в 7 лабораториях, были опубликованы в 2003 г. [59]. Устранение мешающих влияний при автоматической деконволюции-идентификации. Можно выделить следующие типы мешающих влияний при использовании программы автоматической обработки AMDIS. Это получение чистых спектров целевых соединений в сложных органических матрицах с большим количеством соединений, образующих «сплошной» фон или идентификация минорных веществ, элюирующихся одним пиком с веществами, присутствующими в большой концентрации. Еще одним фактором, приводящим к «пропуску» вещества в пробе было искажение формы пика целевого вещества при перегрузке колонки (метаболиты JWH-018, JWH-250). Также не удается идентифицировать вещества, поздно элюирующиеся из колонки при выбранных температурных режимах хроматографирования (зопиклон, силденафил (виагра) и ее аналоги: варденофил, тадалофил). Перечисленные мешающие влияния устраняли, изменяя условия пробоподготовки и анализа следующим образом. В случае анализа сложных матриц (загнившие ткани, волосы, а также контрольные пробы биообъектов, проступающие в лабораторию при проведении профессионального тестирования, готовили шесть аликвот или навесок пробы 1-А6, которые анализируют (в последовательности с использованием автосамплера) по схеме, приведенной в Табл. 4. Изменяемыми параметрами являются: деление потока при вводе пробы для снятия перегрузки колонки, использование «быстрой» и «плавной» температурных программ, что позволяет определять «тяжелые» вещества. Анализ дериватизованной и недериватизованной пробы позволяет элюировать вещества в области хроматограммы свободной от фона. Анализ гидролизованной и нативной пробы позволяет определять малые содержания конъюгированных и лабильных веществ, соответственно. Проблемы AMDIS идентификации обычно связаны с хроматографическими наложениями или деградацией определяемых веществ при пробоподготовке. Можно привести следующие примеры хроматографических наложений трудно разделяемые при автоматической деконволюции-идентификации: 1. Кетамин и идентифицированный нами ангидротрамадол (продукт деградации трампадола при кислотном гидролизе). 2 2. Норпромедол и продукт гидролиза диазепама 2-метиламино-5-хлорбензофенона (МБХ). Таблица 4. Пример изменяемыех условий подготовки пробы и анализа)
*«Плавная» температурная программа: 50°C (0,5мин), 99°C/мин 100°C (1мин), 15°C/мин, 280°C (25мин). Трансляция фиксированных времен удерживания на колонки с метилфенилсилоксановой фазой. К настоящему времени трансляция метода выполнена на более чем 50 колонках HP-5MS производства фирмы J&W и на 4-х колонках VF-5MS производства фирмы Varian. Параметры колонок обеих фирм были одинаковы: длина колонок 30 м, внутренний диаметр 0.25 мм, толщина пленки неподвижной фазы 0.25 мкм. Использовали две температурные программы приведенные выше. Настройку шкалы фиксированных времен удерживания осуществляли по времени удерживания внутреннего стандарта – дифениламина. Заданное время удерживания 9.26 и 5.54 мин для «плавной» и «быстрой» программы получали, меняя давление или поток через колонку. При трансляции метода на колонки HP-5MS воспроизводимость фиксированных времен удерживания была не хуже ±0.05 мин. Попытки транслировать метод на колонки разных производителей оказались менее удачными. Несовпадение фиксированных времен удерживания варьировало от 0.01 для никотина, амфетамина, метамфетамина до 0.8 мин для папаверина и хингамина, и до 1.5 мин для дегидроандростерона. Полученные результаты, как и в случае трансляции фиксированных времен на колонки FFAP, дают основания утверждать, что табличные индексы удерживания можно надежно использовать только в тех случаях, когда они получены на колонке одного производителя в условиях полностью идентичных выбранным для анализа. При этом следует отметить важность и полезность применения табличных индексов удерживания в поисковом режиме при идентификации веществ по масс-спектру. Контроль правильности измерений. Перед анализом серии проб анализировали заведомо положительные и отрицательные пробы (QC и BLANK). Между пробами анализировали этилацетат по «быстрой» программе для контроля фона прибора. При анализе проб контролировали интенсивность пика внутреннего стандарта. Способ выявления неизвестных веществ в сложных органических матрицах биологического происхождения (на примере идентификации нового метаболита кетамина). Задача работы – выявить новые потенциально активные метаболиты, которые могли отвечать за побочные действие препарата. Нами предложены следующие этапы идентификации неизвестного вещества. 1. Выявление спектров с m/z совпадающими с базовыми ионами основного вещества или его метаболитов и составляющие систему признаков. Для веществ, родственных кетамину, это ионы m/z 237, 223, 221, 209, 207, 195, 180, 166, 153, 152, 138, 131, 115. На этом этапе выявили два новых вещества, которые могут являться потенциальными метаболитами (см. Табл. 5). 2. Первоначально эти вещества были обнаружены в моче всех обследованных хирургических больных, получавших кетамин вместе с другими препаратами при анестезии (см. Рис. 3). Также их обнаружили и в моче крыс, которым вводили кетамин. Исследовали примесный состав кетамина различных фирм-производителей. Показано, что исследуемые вещества не являются примесными компонентами кетамина. Эти вещества также могли быть артефактами – продуктами деградации известных метаболитов или самого кетамина при кислотном гидролизе, щелочной экстракции или анализе. Для проверки этого предположения проводили повторный анализ экстрактов с малым содержанием этих веществ после выдержки экстракта в среде насыщенной водной щелочи в течение 12 ч при 80°C. Анализ проводили при различных температурах инжектора (210-310°C). Показано, что содержание этих веществ при повторном анализе не изменилось. 3. Для выявления молекулярного иона проводили детектирование методом квадрупольной масс-спектрометрии и методом масс-спектрометрии типа «ионная ловушка», где из-за условий ионизации более выражены протонированные молекулярные ионы. Исследуемым веществам были приписаны четные молекулярные массы 208 и 206 а.е.м., которые позволили предположить отсутствие азота в молекуле исследуемых веществ. Анализ с беспламенным азотно-фосфорным детектированием также показал отсутствие атома азота в исследуемых веществах. 4. Функциональные группы у исследуемых веществ выявляли анализом дериватизованных проб. В качестве дериватизующих агентов использовали BSTFA и TFAA. Исследуемые вещества дериватов не образовывали, что позволило идентифицировать их как дезаминоноркетамин и его ненасыщенный аналог дезамино-5,6-дегидроноркетамин. Предпринята попытка встречного синтеза идентифицированных веществ (А.А. Формановский). В результате синтеза был получен изомер эпоксиизомер дезаминоноркетамина с близхким масс-спектром. Как показали исследования, синтез этого соединения сложен из-за наличия активного водорода в положении 2 циклогексанонового кольца, что обусловило крайне необычные способности данных веществ к конъюгированию. Исследование II стадии метаболизма (коньюгации) новых метаболитов кетамина. В предположении, что дезаминоноркетамин («1») и 5,6-дегидродезаминоноркетамин («2») могут быть артефактами (см. Рис. 3, 4), формирующимися при кислотном гидролизе, провели анализ свободных и гидролизованных фракций мочи хирургических больных и крыс, получавших кетамин. При кислотном гидролизе (5М HCl 90°C 45 мин) отмечали резкое увеличение (на 1.5-2 порядка величины) концентрации обоих веществ, что и могло свидетельствовать об их артефактном образовании при кислотном гидролизе. Для проверки этого предположения те же пробы анализировали после ферментного гидролиза (Helix Pomatia, Sigma HP-2, рН 5,5 37°C, 24ч). При этом были получены сравнимые с предыдущим опытом результаты – также наблюдали резкое увеличение концентрации веществ «1» и «2». Ранее было показано, что эти вещества не содержат функциональных групп и, соответственно, не образуют производных, в том числе и коньюгатов с глюкуроновой и другими кислотами. Однако факт увеличения концентрации обоих веществ после ферментативного гидролиза говорит именно об образовании коньюгатов, причем фермент Helix Pomatia наиболее селективно разрушает О-гликозидную связь глюкуроконьюгатов. Нами предложено следующее объяснение этого наблюдаемого в эксперименте факта. Известно, что благодаря наличию подвижного атома водорода в положении 2 циклогексанонового кольца у веществ «1» и «2» (после потери аминогруппы на I стадии метаболизма) они являются таутомерами, способны образовывать енольную форму и, соответственно, коньюгировать с образованием О-глюкуронидов. При разрушении глюкуронида вещества «1» и «2» переходят в кето- форму, которая и фиксируется при анализе. Известно, что свободные енольные формы таутомеров не определяются хроматографическим анализом. Сам кетамин и его основные метаболиты норкетамин и 5,6-дегидроноркетамин выделяются с мочой преимущественно в неконьюгированном виде (см. Табл.5). Таблица 5. Масс-спектры и фиксированные времена удерживания кетамина, его метаболитов и примесных веществ 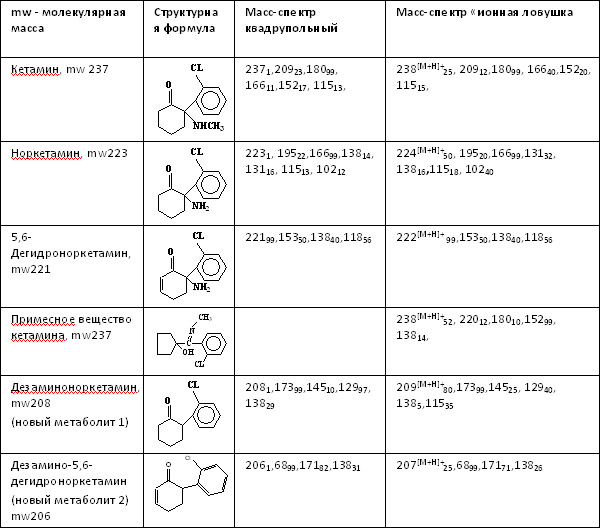 Рис. 3. Хроматограммы по полному ионному току мочи хирургического больного, получавшего кетамин и другие препараты внутривенного наркоза. 12, 13 – новый метаболит кетамина и его ненасыщенный аналог 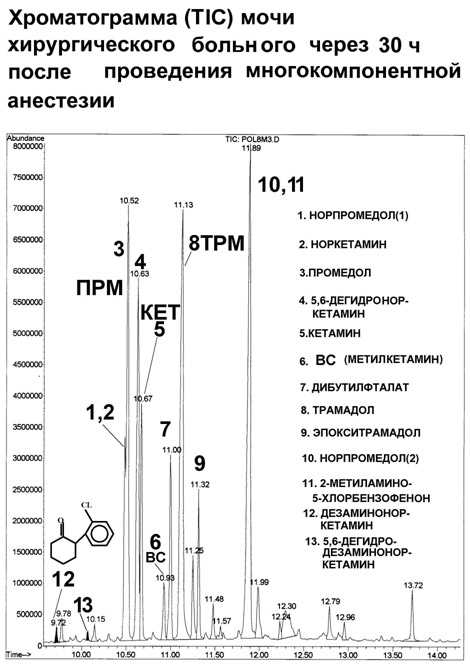 Рис. 4. Хроматограммы по полному ионному мочи крыс, получавших кетамин (30 мг/кг). 12, 13 – новый метаболит кетамина и его ненасыщенный аналог. 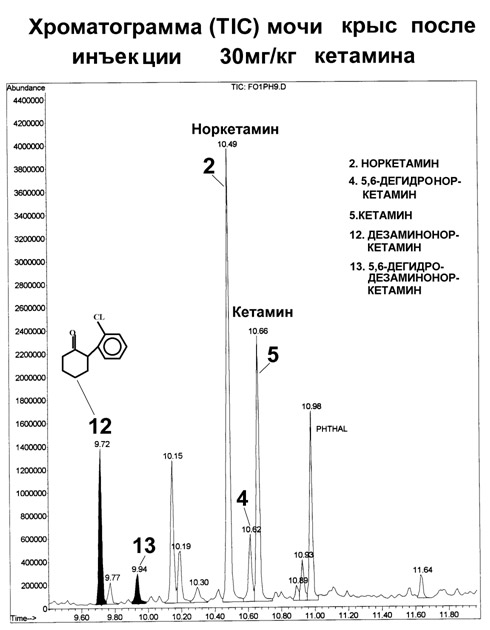 Трамадол, связь между структурой метаболитов и примесных веществ. Методический подход выявления и идентификации новых метаболитов (описанный выше для идентификации новых метаболитов кетамина) применили для исследования препарата трамадол. В большинстве исследованных нами случаев метаболиты ТРМ в значимом количестве были зарегистрированы только в моче больных получавших ТРМ в дозе 50-100 мг. При этом основным метаболитом был О-деметилтрамадол, содержание которого не превышало 10% от содержания ТРМ определяемого в моче. Для дифференциации метаболитов и примесных веществ ТРМ определяли состав примесей активного вещества препарата ТРАМАЛ (Grunental, Германия). Было обнаружено примесное вещество с молекулярной массой 261 а.е.м.. Масс-спектр и вероятная структура этого соединения, идентифицированного (по масс-спектру) как эпокситрамадол приведены в Табл. 6. Это вещество обнаруживали в следовых концентрациях и в моче больных, получавших ТРМ. Однако в ряде исследованных случаев мы наблюдали иную картину. В пробах мочи, отобранных через 3 суток после проведения хирургической операции, регистрировали содержание эпокситрамадола сравнимое с содержанием самого ТРМ, что позволяют предположить кумуляцию эпокситрамадола в организме или путь метаболизма, приводящий к образованию метаболита со сходной структурой. Таблица 6. Масс-спектры трамадола и родственных соединений 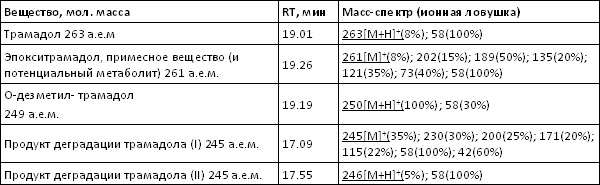 Список литературы 1. Савчук С.А., Нужный В.П. Рожанец В.В.. Химия и токсикология этилового спирта и напитков, изготовленных на его основе. Хроматографический анализ спиртных напитков М.2011, URSS. «Либроком» 181 с. 2. Нужный В.П. Рожанец В.В.. Савчук С.А.Химия и токсикология этилового спирта и напитков, изготовленных на его основе. Токсикология. М. 2011, URSS. «Либроком» 201 с. 3. Нужный В.П., Савчук С.А. Нелегальный алкоголь в России. Сравнительная токсичность и влияние на здоровье населения. Глава в коллективной монографии «Алкогольная катастрофа и возможности государственной политики в преодолении алкогольной смертности в России». Российская академия государственной службы при Президенте Российской Федерации, Совет Министров северных стран. М. Ленанд .2008 с.172-231. 4. Савчук С.А., Чибисова М.В., Анохин Л.А., Способ выявления и определения происхождения неизвестных веществ в спиртных напитках Патент на изобретение (19)RU(11) 2392616 С1 МПК GO1N 30/02 (2006 01) Опубликовано 20.06.2010 Бюлл. №17. 5. Савчук С.А. Апполонова С.А. Двухканальный газовый хроматограф для выявления фальсифицированного алкоголя и летучих ядов. Патент на полезную модель (19)RU(11) 83849 (13) U1 (51) МПК G01N 30/02 (2006.01). Опубликовано 20.06.2009 Бюлл. № 17. 6. Савчук С.А. Система удаленной идентификации и распознавания объектов сложного состава Патент на полезную модель (19)RU(11) 77474 (13) (51) МПК G06K 17/00 (2006.01). Опубликовано 20.10.2008 Бюлл. № 29. 7. Савчук С.А., Апполонова С.А. Способ идентификации наркотических и психоактивных веществ в биологических жидкостях. Патент на изобретение RU 2390771 С1 МПК GO1N 30/86 (2006 01). Опубликовано27.05.2010 Бюлл. №15. 8. Савчук С.А., Чибисова М.В., Апполонова С.А. Анохин Л.А., Способ выявления неизвестных веществ в биологических жидкостях пациентов, принимавших наркотические или психоактивные вещества. Патент на изобретение RU 2419788. Опубликовано 18.05.2011 г. 9. Савчук С.А., Власов В.Н., Апполонова С.А., Арбузов В.Н., Веденин А.Н., Мезинов А.Б., Григорьян Б.Р. Применение хроматографии и спектрометрии для идентификации подлинности спиртных напитков (обзор). // Журнал Аналитической химии. 2001 Т. 56. № 3. С. 246-264. 10. Савчук С.А., Бродский Е.С., Формановский А.А. Газохроматографическое и хромато-масс-спектрометрическое определение гликолей в питьевой воде и спиртных напитках. // Журнал Аналитической Химии. 1999. Т.54. №8. С. 836-847. 11. Савчук С.А., Г.М. Колесов Маркеры природы этилового спирта: хроматографические методы их обнаружения. // Журнал Аналитической Химии. 2005. Т.60. №12. С.1239-1250. 12. Арбузов В.Н., Савчук С.А.Идентификация водок методами ионной и газовой хроматографии. // Журнал Аналитической Химии. 2002. Т57. №5. С.515-521. 13. Савчук С.А., Нужный В.П. Химический состав и потенциальная токсичность образцов легальной и нелегальной алкогольной продукции // Наркология. №7. С.67-76 14. Нужный В.П., Савчук С.А.Токсичность алкогольных напитков и ацетон. // Токсикологический вестник. 2005. №6. С.1-3. 15. Савчук С.А., Нужный В.П., Колесов Г.М. Факторы, влияющие на правильность определения диэтилфталата в водке, этаноле и образцах нелегальной алкогольной продукции. // Журнал Аналитической Химии. 2006. Т.61. №12. С.1301-1307. 16. Савчук С.А., Колесов Г.М. О правильности хроматографического определения эфиров фталевых кислот, как показателя фальсификации коньяков и коньячных спиртов. // Журнал Аналитической химии. 2007. № 8. Т. 62. С. 845-857. 17. Вязьмина Н.А., Савчук С.А. Применение методов газовой хроматографии для идентификации происхождения спирта. // Журнал Аналитической Химии. 2002. Т 57. №8 С. 813-819. 18. Савчук С.А., Колесов Г.М. Хроматографические методы в контроле качества коньяков и коньячных спиртов. // Журнал Аналитической Химии. 2005. Т.60. №8. С.848-868. 19. Нужный В.П. Савчук С.А., Каюмов Р.И. Химико-токсикологическое исследование крепких алкогольных напитков домашнего изготовления (Самогон из разных регионов России). // Наркология. 2002. №5. С. 43-48. 20. Нужный В.П., Савчук С.А., Тюрин И.А., Белов С.К. Проблема денатурирующих добавок к этиловому спирту в связи с исследованием образцов нелегальной алкогольной продукции. // Токсикологический вестник. 2004. май-июнь. С.7-12. 21. Савчук С. А. Новый метод микроэкстракции для идентификации подлинности и токсикологической безопасности пива и вин методами хромато-масс-спектрометрии. // Наркология №4. С. 67—89. 22. Симонов Е.А., Сорокин В.И., Савчук С.А. Применение газовой хроматографии и хромато-масс-спектрометрии для определения гамма-гидроксимасляной кислоты и её прекурсоров в объектах различного происхождения. // Журнал Аналитической Химии. 2004. Т.59. №10. С.1070-1076. 23. Савчук С.А., Веденин А.Н., Изотов Б.Н. Обнаружение летучих токсичных веществ в биологических жидкостях организма методом газовой хроматографии и хромато-масс-спектрометрии. // Наркология 2002. №3. С.37-45. 24. Б.А. Руденко, С.А.Савчук, Е.С.Бродский. Хроматографическое определение обезболивающих наркотических средств (Обзор). // Журнал Аналитической Химии. 1996. Т51. №2. 182-201. 25. Веселовская Н.В., Савчук С.А., Изотов Б.Н., Свойства и анализ опиоидного анальгетика трамадола (Обзор). // Вопросы наркологии 1998. №2. С. 41-53. 26. Савчук С.А., Веселовская Н.В., Бродский Е.С., Формановский А.А., Чистяков В.В., Изотов Б.Н. Применение хроматографии и хромато-масс- спектрометрии для изучения фармакокинетики и метаболизма пропофола, клофелина, фенциклидина и трамадола (Обзор). // Хим.-Фарм. Журнал. 1999. №10. С. 29-52. 27. Веселовская Н.В., Савчук С.А., Изотов Б.Н. Хроматографический анализ фенциклидина, его метаболитов и аналогов в биологических жидкостях (обзор). // Судебно медицинская экспертиза 1999. №2. С.20-25. 28. Савчук, С.А., Симонов Е.А., Сорокин, В.И. Дорогокупец О.Б., Веденин А.Н. Применение метода фиксации времен удерживания при хромато-масс-спектрометрическом и хроматографическом определении наркотических средств. // Журнал Аналитической Химии. 2004. Т.59. №10. С.1059-1069. 29. С.А.Савчук, Б.А.Руденко, Н.А.Давыдова, Е.С.Бродский, Т.Ф. Боровкова. Определение анестезирующего препарата кетамин в крови методом капиллярной газовой хроматографии с применением термоионного детектирования и хромато-масс-спектрометрии. // Журнал Аналитической Химии. 1995. Т50. №12. С. 1324-1329. 30. С.А.Савчук, Е.С.Бродский, Б.А.Руденко, А.А.Формановский, И.В.Михура, Н.А.Давыдова. Хромато-масс-спектрометрическое определение продуктов биотрансформации анестезирующего препарата Кетамин. // Журнал Аналитической Химии. 1997. Т52. №12. С. 1299-1311. 31. С.А.Савчук, Е.С.Бродский, А.А.Формановский, В.В.Ерофеев, Е.В.Бабанова, В.В. Чистяков, М.Л. Рабинович, О.А.Долина, Б.А.Руденко. Применение газовой хроматографии с селективным детектированием и хромато-масс-спектрометрии для идентификации метаболитов Кетамина и исследования процессов конъюгации Кетамина и его метаболитов в организмах человека и крыс. // Журнал Аналитической Химии. 1998. Т53. №.6. С 663-670. 32. С.А.Савчук, Е.С.Бродский, А.А.Формановский, Е.В.Бабанова, Н.В.Веселовская, Б.Н.Изотов, Г.М. Родченков, В.В.Ерофеев, Б.А.Руденко Артефакты при хромато-масс-спектрометрическом определении препаратов для внутривенного наркоза (I). Трамадол, связь между структурой метаболитов и примесных веществ (II). // Журнал Аналитической Химии. 2000. Т 55. № 4. С.430-442. 33. ЛазаревВ,В., Галибин И.Е., Cавчук С.А., Изотов Б.Н., Веденин А.Н., Р.П.Васина Фармакокинетика и метаболизм кетамина на фоне болюсного введения рентгеноконтрастных средств при рентгеноэндоваскулярных вмешательствах у детей. // Анестезиология и реаниматология. 2001. №1. С.38-43. 34. Симонов Е.А., Савчук С.А., Сорокин В.И., Кислун Ю.В., Клюев Е.А. Оксибутират, его прекурсоры и метаболиты. // Наркология. 2002. №3. С.12-19. 35. Барсегян С.С., Савчук С.А., Барам Г.И., Барсегян И.Б., Гелемеев В.Ф. Комплексное исследование экспертных объектов, содержащих дезоморфин. // Наркология. 2007. №2. С. 13-21. 36. С. А. Савчук, С. С. Барсегян, И. Б. Барсегян, Г. М. Колесов. Хроматографическое исследование экспертных образцов, содержащих дезоморфин. // Журнал Аналитической химии. 2008. Т 63. № 4. С. 396-405. 37. Лазарев В. В., Михельсон В. А., Бураков А. А., Изотов Б. Н., Савчук С. А. Водный баланс и фармакокинетика кетамина при анестезиологическом обеспечении рентгеноэндоваскулярных вмешательств у детей. // Анестезиология и реаниматология. 2004. №1. С. 23-27. 38. А.М. Григорьев, С.А Савчук Согласование параметров обзорных библиотек газохроматографического удерживания. // Журнал Аналитической химии. 2010.Тl. 65. №. 4. С. 388–397. 39. Andrej Grigoryev, Sergey Savchuk, Aleksandra Melnik, Natal’ja Moskaleva, Jurij Dzhurko,Mihail Ershov, Aleksandr Nosyrev, Aleksandr Vedenin, Boris Izotov, Irina Zabirova, Vladimir Rozhanets. Chromatography–mass spectrometry studies on the metabolism of synthetic cannabinoids JWH-018 and JWH-073, psychoactive components of smoking mixtures/ // Journal of Chromatography B, 879 (2011) 1126–1136. 40. Andrej Grigoryev, Aleksandra Melnik, Sergey Savchuk, Anton Simonov, Vladimir Rozhanets. Gas and liquid chromatography–mass spectrometry studies on the metabolism of the synthetic phenylacetylindole cannabimimetic JWH-250, the psychoactive component of smoking mixtures // Journal of Chromatography B, 879 (2011) 2519– 2526. 41. Савчук С.А., Гофенберг М.А., Никитина Н.М., Надеждин А.В., Тетенова Е.Ю. Определение маркеров синтетических каннабимиметиков PB-22, PB-22F, AB-PINACA, AB-FUBINACA в волосах и моче методом ГХ-МС. // Наркология №11 2013 с.60-66. 42. Савчук С.А., Б.Н.Изотов. Информационное письмо «Обнаружение метаболитов синтетических каннабимиметиков в моче, волосах и сыворотке крови методом газовой хроматографии с масс-селективным детектированием» // Наркология №1 2014 с.91-95. 43. Савчук С.А., Григорьев А.М.,. Катаев С.С., Б.Н.Изотов, Гофенберг М.А., Гизетдинова Л.А., Мингазов А.А., Никитина Н.М. Информационное письмо «Идентификация наркотических и психоактивных веществ в биологических жидкостях и волосах методом газовой хроматографии с масс-селективным детектированием» // Наркология №1 2014 С.97-98. 44. Гизетдинова Л. А., Мингазов А. А., Нугманова Р. Р., Дернова О. А., Пиляева А. Р., Савчук С. А. Хромато-масс-спектрометрическое определение нового наркотического средства метоксетамина и синтетических каннабимиметиков PB22, PB22F, AB-PINACA, AB-FUBINACA, FUB-PB-22 в биологических жидкостях и образцах волос в Набережночелнинском наркологическом диспансере. // Наркология №3. 66—73 стр. 45. Савчук С.А., Гофенберг М.А., Никитина Н.М., Гизетдинова Л.А., Мингазов А.А., Скребкова К.А., Самышкина Н.В., Ризванова Л.Н., Кошелева Ю.В.Шевырин В.А., Катаев С.С., Григорьев А.М. Информационное письмо «Обнаружение синтетических каннабимиметиков, наркотических, психоактивных веществ и их метаболитов в моче, волосах и ногтях методами жидкостной хроматографии с масс-спектрометрическим детектированием» // Наркология 2014, №8 С.65-75. 46. Савчук С.А., Никитина Н.М, Бондарь И.В., Надеждин А.В, Тетенова Е.Ю., Ковинька М.А., Богинская Д.Д. Оптимизация методов пробоподготовки волос для анализа наркотических веществ методом газовой хроматографии с масс-селективным детектированием. // Наркология . 2014, №8 С.76-82. 47. Арбузов В.Н., Савчук С.А., Алешкин Б.М., Фролова И.В. Комплексное применение методик для определения подлинности водок. // Партнеры и конкуренты. Журнал для органов по сертификации и испытательных лабораторий Госстандарта России. 2001.№ 8. С. 22-25. 48. С.А.Савчук. К вопросу об идентификации природы этилового спирта. // Партнеры и Конкуренты. 2005. №1. С.32-38. 49. С.А.Савчук. К вопросу об идентификации природы этилового спирта (продолжение). // Партнеры и Конкуренты. 2005. №3. С.30-34. 50. Н.А.Вязьмина, С.А.Савчук. Идентификация примесей этанола с использованием хроматографических колонок различного типа // Партнеры и Конкуренты. 2005. №7. С.32-38. 51. Н.А.Вязьмина, С.А.Савчук. Идентификация примесей этанола с использованием хроматографических колонок различного типа. // Партнеры и Конкуренты. 2005. №7. С.22-27 (продолжение). 52. Вязьмина Н.А., Савчук С.А.Исследование примесного состава этилового спирта и продуктов его ректификации. // Партнеры и Конкуренты. 2002. №2 С. 30-40. 53. С.А.Савчук, В.Н. Власов Идентификация винодельческой продукции методами высокоэффективной хроматографии и спектрометрии // Виноград и вино России. 2000. №5. С.5-13. 54. Савчук С.А. Контроль качества и идентификация подлинности коньяков хроматографическими методами. // Методы оценки соответствия. №8(2). С. 18-24. 55. Савчук С.А. Контроль качества и идентификация подлинности коньяков хроматографическими методами. // Методы оценки соответствия. №8(2). С. 30-36. 56. Нужный В.П., С.А.Савчук, Демешина И.В., Забирова И.Г., Листвина В.П., Самойлик Д.В., Суркова Л.А., Тезиков Е.Б. Состав и токсичность самогонов из сахара и меда. // Реферативный сборник новости науки и техники ВИНИТИ 1999. серия Медицина. Выпуск Алкогольная болезнь. С. 1-10. 57. Нужный В.П., Савчук С.А., Демешина И.В., Забирова И.Г., Листвина В.П., Самойлик Д.В., Суркова Л.А., Тезиков Е.Б. Химический состав, острая и подострая токсичность крепких алкогольных напитков домашнего изготовления (самогоны). // Государственный комитет по стандартизации и метрологии РФ. Академия стандартизации, метрологии и сертификации (учебная). Проблемы идентификации алкогольсодержащей продукции, Сборник трудов. Госстандарт России. Москва 2001. С.138-154. 58. Савчук С.А., Кобелев К.В., Рыжова Т.П., Арбузов В.Н., Апполонова С.А.,Симонов Е.А., Сорокин В.И. Применение новых хроматографических методов в исследовании пива. // Пиво и напитки 2003. №1. С. 15-21. 59. В.П. Нужный, С.А.Савчук. Алкогольная смертность и токсичность алкогольных напитков. // Партнеры и Конкуренты. 2005. №5. С.18-26. 60. В.П. Нужный, С.А.Савчук. Алкогольная смертность и токсичность алкогольных напитков. // Партнеры и Конкуренты. 2005. №5. С.27-34 (продолжение). 61. В.П. Нужный, С.А.Савчук. Алкогольная смертность и токсичность алкогольных напитков. // Партнеры и Конкуренты. 2005. №6. С.27-34 (продолжение). 62. В.П. Нужный, С.А.Савчук Алкогольная смертность и токсичность алкогольных напитков. // Партнеры и Конкуренты. 2005. №7. С.25-31 (продолжение). 63. С.А.Савчук, А.Н.Веденин. Применение программы фиксации времен удерживания при хромато-масс-спектрометрическом определении анализируемых веществ. // Российский химический журнал (Ж.Рос.хим.об-ва им. Д.И.Менделеева). 2003. Т.XLVII. №1. С.141. 64. Лазарев В,В., Поляев Ю.А., Cавчук С.А., Изотов Б.Н. Влияние болюсного введения рентгеноконтрастных средств на фармакокинетику кетамина и течение анестезии при рентгенохирургических вмешательствах у детей. // Научно-практический журнал «Детская больница». 2001. №2. С.12-17. 65. С.А.Савчук, А.Н.Веденин, А.В.Смирнов, Е.А.Симонов, О.Б.Дорогокупец, В.И.Сорокин, Ю.В.Кислун. Исследование влияния продуктов и лекарственных препаратов на правильность определения опиатов и некоторых других наркотических средств в биологических объектах (моче). // Лабораторный журнал. 2002. №2. 18-23.
Abstract The paper critically analyzes the current system approach concepts of solving the problem of chromatographic detection of metabolites of new psychoactive substances in biological objects and detection of counterfeit alcohol. New approaches to the use of gas chromatography-mass spectrometry analysis based on the selection of characteristic markers are proposed for the solution of problems of expert identification of new metabolites, authentication of alcohol-containing samples, methods for their production, the establishment of the common origin of the investigated objects, or their attachement to a single array. Key words chromatography-mass spectrometry analysis, drugs, food, medicined, strong drinks, authenticity of the samples, analytical methods References 1. Savchuk, S.A, V.P Nuzhnyj, V.V Rojanets Chemistry and Toxicology of ethyl alcohol and beverages made from it. Chromatographic analysis of spirits. Moscow: Librocom, 2011. Print. 2. Nuzhnyj, V.P, V.V Rojanets, S.A Savchuk Chemistry and Toxicology of ethyl alcohol and beverages made from it. Toxicology. Moscow: Librocom, 2011. Print. 3. Nuzhnyj, V.P, S.A Savchuk Illegal alcohol in Russia. Comparative toxicity and impact on public health. Chapter in monograph "Alcohol catastrophe and the possibility of public policy in overcoming alcohol deaths in Russia." Russian Academy of Public Service under the President of the Russian Federation, The Nordic Council of Ministers/ Moscow: Lenand, 2008. Print. 4. Savchuk, S.A, M.V Chibisova, L.A Anokhin A process to identify and determine the origin of unknown substances in alcoholic beverages. Patent for invention (19)RU(11) 2392616 С1 МПК GO1N 30/02 (2006 01). 5. Savchuk, S.A, S.A Apollonova Dual channel gas chromatograph for identification of adulterated alcohol and volatile poisons. Utility patent (19)RU(11) 83849 (13) U1 (51) МПК G01N 30/02 (2006.01). 6. Savchuk, S.A System for remote identification and recognition of objects of complex composition. Utility patent (19)RU(11) 77474 (13) (51) МПК G06K 17/00 (2006.01). 7. Savchuk, S.A, S.A Apollonova A method for identifying narcotic and psychoactive substances in biological fluids. Patent for invention RU 2390771 С1 МПК GO1N 30/86 (2006 01). 8. Savchuk, S.A, M.V Chibisova, S.A Apollonova, L.A Anokhin A method to identify unknown substances in biological fluids of patients taking drugs or substances. Patent for invention RU 2419788. 9. Savchuk, S.A, V.N Vlasov, S.A Apollonova, V.N Arbuzov, A.N Vedenin, A.B Mezinov, B.R Grigoryan “Application of chromatography and spectrometry for identification of the authenticity of alcoholic beverages (Review).” Journal of Analytical Chemistry 3 (2001): 246-264. 10. Savchuk, S.A, E.S Brodsky, A.A Formanovsky “Gas chromatographic and gas chromatography-mass spectrometric determination of glycol in drinking water and alcoholic drinks.” Journal of Analytical Chemistry 8 (1999): 836-847. 11. Savchuk, S.A, Kolesov G.M “Ethyl alcohol nature markers: chromatographic methods for their detection.” Journal of Analytical Chemistry 12 (2005): 1239-1250. 12. Arbuzov, V.N, S.A Savchuk “ Identification of vodkas by methods of ion and gas chromatography.” Journal of Analytical Chemistry 5 (2002): 515-521. 13. Savchuk, S.A, V.P Nuzhnyj “Chemical composition and potential toxicity of samples of legal and illegal alcohol production.” Narkologia 7 (2006): 67-76. 14. Nuzhnyj, V.P, S.A Savchuk “Toxicity of alcoholic beverages and acetone.” Toxicological Review 6 (2005): 1-3. 15. Savchuk, S.A, V.P Nuzhnyj, G.M Kolesov “Factors affecting the accuracy of the determination of diethyl phthalate in vodka, ethanol, and samples of illegal alcoholic beverages.” Journal of Analytical Chemistry 12 (2006): 1301-1307. 16. Savchuk, S.A, G.M Kolesov “On the correctness of the chromatographic determination of phthalate esters, as an indicator of the falsification of cognacs and brandy spirits.” Journal of Analytical Chemistry 8 (2007): 845-857. 17. Vyazmina, N.A, S.A Savchuk “Application of gas chromatography to identify the origin of the alcohol.” Journal of Analytical Chemistry 8 (2002): 813-819. 18. Savchuk, S.A, G.M Kolesov “ Chromatographic methods in quality control of cognacs and brandy spirits.” Journal of Analytical Chemistry 8 (2005): 848-868. 19. Nuzhnyj, V.P, S.A Savchuk, R.I Kajumov “Chemical-toxicological study of homemade spirits (Moonshine from different regions of Russia)” Narkologia 5 (2002): 43-48. 20. Nuzhnyj, V.P, S.A Savchuk, I.A Turin, S.K Belov “Problem of denaturing additives to ethyl alcohol in connection with the investigation of samples of illegal alcoholic beverages.” Toxicological Review 5-6 (2004): 7-12. 21. Savchuk, S.A “A new microextraction method to identify the authenticity and toxicological safety of beers and wines by gas chromatography-mass spectrometry.” Narkologia 4 (2014): 67-89. 22. Simonov, E.A, V.I Sorokin, S.A Savchuk “Application of gas chromatography and gas chromatography-mass spectrometry for the determination of gamma-hydroxybutyric acid and its precursors in the objects of different origin.” Journal of Analytical Chemistry 10 (2004): 1070-1076. 23. Savchuk, S.A, A.N Vedenin, B.N Izotov “Detection of volatile toxic substances in biological fluids by gas chromatography and gas chromatography-mass spectrometry.” Narkologia 3 (2002): 37-45. 24. Rudenko, B.A, S.A Savchuk, E.S Brodsky “Chromatographic detection of analgesic narcotic drugs (Review).” Journal of Analytical Chemistry 2 (1996): 182-201. 25. Veselovskaya, N.V, S.A Savchuk, B.N Izotov “Properties and analysis of tramadol opioid analgesic (Review).” Voprosy Narkologii 2 (1998): 41-53. 26. Savchuk, S.A, N.V Veselovskaya, E.S Brodsky, A.A Formanovsky, V.V Chistyakov, B.N Izotov “Application of chromatography and gas chromatography-mass spectrometry to study the pharmacokinetics and metabolism of propofol, clonidine, tramadol, and phencyclidine (Review).” Khimiko-Farmatsevticheskii Zhurnal 10 (1999): 29-52. 27. Veselovskaya, N.V, S.A Savchuk, B.N Izotov “Chromatographic analysis of phencyclidine, its metabolites and analogs in biological fluids (review).” Sudebno-Meditsinskaya Ekspertiza 2 (1999): 20-25. 28. Savchuk, S.A, E.A Simonov, V.I. Sorokin, O.B. Dorogokupets, A.N Vedenin “Application of fixing the retention times method under gas chromatography-mass spectrometric and chromatographic detection of drugs.” Journal of Analytical Chemistry 10 (2004): 1059-1069. 29. Savchuk, S.A, B.A Rudenko, N.A Davydova, E.S Brodsky, T.F Borovkova “Detection of ketamine anesthetic drug in the blood by capillary gas chromatography applying thermionic detection and gas chromatography-mass spectrometry.” Journal of Analytical Chemistry 12 (1995): 1324-1329. 30. Savchuk, S.A, E.S Brodsky, B.A Rudenko, A.A Formanovsky, I.V Mikhura, N.A Davydova “Chromatography-mass spectrometric detection of the biotransformation products of the ketamine anesthetic drug.” Journal of Analytical Chemistry 12 (1997): 1299-1311. 31. Savchuk, S.A, E.S Brodsky, A.A Formanovsky, V.V Erofeev, E.V Babanova, V.V Chistyakov, M.L Rabinovich, O.A Dolina, B.A Rudenko “Application of gas chromatography with selective detection and gas chromatography-mass spectrometry for identification of metabolites of ketamine and research of ketamine conjugation processes and its metabolites in humans and rats.” Journal of Analytical Chemistry 6 (1998): 663-670. 32. Savchuk, S.A, E.S Brodsky, A.A Formanovsky, E.V Babanova, N.V Veselovskaya, B.N Izotov, G.M Rodchenkov, V.V Erofeev, B.A Rudenko “Artifacts under gas chromatography-mass spectrometric detection of drugs for intravenous anesthesia (I). Tramadol, connection between the structure of metabolites and impurity substances (II).” Journal of Analytical Chemistry 4 (2000): 430-442. 33. Lazarev, V.V, I.E Galibin, S.A Savchuk, B.N Izotov, A.N Vedenin, R.P Vasina “The pharmacokinetics and metabolism of ketamine on background of bolus introduction of contrast media during X-ray endovascular interventions in children.” Anesteziologiya i Reanimatologiya 1 (2001): 38-43. 34. Simonov, E.A, S.A Savchuk, V.I Sorokin, J.V Kislun, E.A Kluev “Hydroxybutyrate, its precursors and metabolites.” Narkologia 3 (2002): 12-19. 35. Barsegyan, S.S, S.A Savchuk, G.I Baram, I.B Barsegyan, V.F Gelemeev “Comprehensive study of expert objects containing desomorphine.” Narkologia 2 (2007): 13-21. 36. Savchuk, S.A, S.S Barsegyan, I.B Barsegyan, G.M Kolesov “Chromatographic study of expert samples containing desomorphine” Journal of Analytical Chemistry 4 (2008): 396-405. 37. Lazarev, V.V, V.A Mikhelson, A.A Burakov, B.N Izotov, S.A Savchuk “Water balance and pharmacokinetics of ketamine anesthesia during X-ray endovascular interventions in children.” Anesteziologiya i Reanimatologiya 1 (2004): 23-27. 38. Grigorjev A.M, S.A Savchuk “Harmonization of gas chromatographic retention libraries.” Journal of Analytical Chemistry 4 (2010): 388-397. 39. Andrej Grigoryev, Sergey Savchuk, Aleksandra Melnik, Natal’ja Moskaleva, Jurij Dzhurko, Mihail Ershov, Aleksandr Nosyrev, Aleksandr Vedenin, Boris Izotov, Irina Zabirova, Vladimir Rozhanets. “Chromatography–mass spectrometry studies on the metabolism of synthetic cannabinoids JWH-018 and JWH-073, psychoactive components of smoking mixtures.” Journal of Chromatography B, 879 (2011) 1126–1136. 40. Andrej Grigoryev, Aleksandra Melnik, Sergey Savchuk, Anton Simonov, Vladimir Rozhanets. “Gas and liquid chromatography–mass spectrometry studies on the metabolism of the synthetic phenylacetylindole cannabimimetic JWH-250, the psychoactive component of smoking mixtures.” Journal of Chromatography B, 879 (2011) 2519– 2526. 41. Savchuk, S.A, M.A Gofenberg, N.A Nikitina, A.V Nadezhdin, E.J Tetenova “Detection of synthetic cannabimimetics PB-22, PB-22F, AB-PINACA, AB-FUBINACA markers in hair and urine samples by GC-MS.” Narkologia 11 (2013): 60-66. 42. Savchuk, S.A, B.N Izotov “Information Letter "On Detection of synthetic cannabimimetics metabolites in urine, hair and serum samples by gas chromatography with mass selective detection".” Narkologia 1 (2014): 91-95. 43. Savchuk, S.A, A.M Grigorjev, S.S Kataev, B.N Izotov, M.A Gofenberg, L.A Gizetdinova, A.A Mingazov, N.M Nikitina “Information letter "Identification of narcotic and psychoactive substances in biological fluids and hair by gas chromatography with mass selective detection"” Narkologia 1 (2014): 97-98. 44. Gizetdinova, L.A, A.A Mingazov, R.R Nugmanova, O.A Dernova, A.R Pilyaeva, S.A Savchuk “Chromatography-mass spectrometric detection of the new drug Methoxetamine and synthetic cannabimimetics PB22, PB22F, AB-PINACA, AB-FUBINACA, FUB-PB-22 in biological fluids and hair samples in Naberezhnye Chelny Drug Dependency Clinic.” Narkologia 3 (2014): 66-73. 45. Savchuk, S.A, M.A Gofenberg, N.M Nikitina, L.A Gizetdinova, A.A Mingazov, K.A Skrebkova, N.V Samyshkina, L.N Rizvanova, J.V Kosheleva, V.A Shevyrin, S.S Kataev, A.M Grigorjev “Information letter "Detection of synthetic cannabimimetics, drugs, psychoactive drugs and their metabolites in urine, hair and nails by liquid chromatography with mass spectrometric detection"” Narkologia 8 (2014): 65-75. 46. Savchuk, S.A, N.M Nikitina, I.V Bondar, A.V Nadezhdin, E.J Tetenova, M.A Kovinka, D.D Boginskaya “Optimization of hair sample preparation methods for the analysis of drugs by gas chromatography with mass selective detection.” Narkologia 8 (2014): 76-82. 47. Arbuzov, V.N, S.A Savchuk, B.M Alyoshkin, I.V Frolova “Integrated application of methods for determining the authenticity of vodkas.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 8 (2001): 22-25. 48. Savchuk, S.A “On the identification of the nature of ethyl alcohol. Part I.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 1 (2005): 32-38. 49. Savchuk, S.A “On the identification of the nature of ethyl alcohol. Part II.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 1 (2005): 32-38. 50. Vyazmina, N.A, S.A Savchuk “Identification of ethanol impurities using different types of chromatographic columns. Part I.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 7 (2005): 32-38. 51. Vyazmina, N.A, S.A Savchuk “Identification of ethanol impurities using different types of chromatographic columns. Part II.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 7 (2005): 22-27. 52. Vyazmina, N.A, S.A Savchuk “Study of the impurity composition of ethanol and its distillation products.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 2 (2002): 30-40. 53. Savchuk, S.A, V.N Vlasov “Identification of wine products by high-performance chromatography and spectrometry methods.” Vinograd i vino Rossyi 5 (2000): 5-13. 54. Savchuk, S.A “Quality control and identification of the authenticity of brandies by chromatographic methods.” Metody otsenki sootvetstviya 8(2): 18-24. 55. Savchuk, S.A “Quality control and identification of the authenticity of brandies by chromatographic methods.” Metody otsenki sootvetstviya 8(2): 30-36. 56. Nuzhnyj, V.P, S.A Savchuk, I.V Demeshina, I.G Zabirova, V.P Listvina, D.V Samoylik, L.A Surkova, E.B Tezikov “Composition and toxicity of moonshine from sugar and honey.” Abstract collection of science and technology news VINITI, 1999.Series Medicine. Issue alcoholism. 1-10. 57. Nuzhnyj, V.P, S.A Savchuk, I.V Demeshina, I.G Zabirova, V.P Listvina, D.V Samoylik, L.A Surkova, E.B Tezikov Chemical composition, acute and subacute toxicity of homemade alcoholic beverages (moonshine). Problems of identifying alcohol products. Proceedings. Moscow: State Committee of Russia for Standards, 2011. Print. 58. Savchuk, S.A, K.V Kobelev, T.P Ryzhova, V.N Arbuzov, S.A Apollonova, E.A Simonov, V.I Sorokin “Application of new chromatographic methods in the study of beer.” Pivo i napitki 1 (2003):15-21. 59. Nuzhnyj, V.P, S.A Savchuk “Alcohol-related mortality and toxicity of alcohol. Part I.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 5 (2005): 18-26. 60. Nuzhnyj, V.P, S.A Savchuk “Alcohol-related mortality and toxicity of alcohol. Part II.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 5 (2005): 27-34. 61. Nuzhnyj, V.P, S.A Savchuk “Alcohol-related mortality and toxicity of alcohol. Part III.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 6 (2005): 27-34. 62. Nuzhnyj, V.P, S.A Savchuk “Alcohol-related mortality and toxicity of alcohol. Part IV.” Partnery i konkurenty. Magazine for certification bodies and testing laboratories of Russian State Agency for technical regulations and metrology 7 (2005): 25-31. 63. Savchuk, S.A, A.N Vedenin “Application of program for retention time fixation under chromatography-mass spectrometric determination of analytes.” Russian Chemical Journal of the Mendeleev Russian Chemical Society 1 (2003): 141. 64. Lazarev, V.V, J.A Polyaev, S.A Savchuk, B.N Izotov “Effect of bolus injection of radiopaque agents on the pharmacokinetics of ketamine and the course of anesthesia during endovascular interventions in children.” Scientific and practical journal Detskaya Bolnitsa 2 (2001): 12-17. 65. Savchuk, S.A, A.N Vedenin, A.V Smirnov, E.A Simonov, O.B Dorogokupets, V.I Sorokin, J.V Kislun “Study of the influence of medicines and food for correct determination of opiates and some other drugs in biological specimens (urine).” Laboratorny Zhurnal 2 (2002): 18-23. |
[ См. также ] Рубрики |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|