| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Особенности прогрессирования поражения печени при инсулинорезистентности
Ответственный автор – Шархун О.О., E-mail: olga_sharkhun@mail.ru Аннотация В статье дается оценка состояния печени у пациентов с неалкогольной жировой болезнью печени (НАЖБП) через 5 лет наблюдения, выявляются особенности прогрессирования патологического процесса в печени у пациентов с инсулинорезистентностью. Печень рассматривается в тесной ассоциации с метаболическим синдромом, в основе формирования которого лежит инсулинорезистентность (ИР). Представлены клинические исходы формирования НАЖБП в течение 5 лет у пациентов с ИР и без нее, а также развитие ИР у пациентов с НАЖБП. Среди пациентов с НАЖБП в течение 5 лет наблюдения оценивается трансформация стеатоза в стеатогепатит, а также степень активности стеатогепатита по клинико-лабораторным данным. Ключевые слова жировой гепатоз, стеатогепатит, инсулинорезистентность, факторы риска, абдоминальное ожирение, анкетирование, пациент, физическая активность Введение Неалкогольная жировая болезнь печени (НАЖБП) является распространенным хроническим заболеванием и рассматривается как самостоятельная нозологическая форма поражения печени невирусного генеза, объединяющая широкий спектр морфологических изменений в печени от стеатоза и стеатогепатита до фиброза и цирроза печени, развившихся у пациентов, не употребляющих алкоголь в гепатотоксичных дозах [1, 2, 7, 10]. НАЖБП тесно ассоциирована с метаболическим синдромом и его компонентами. При этом печень выступает в роли не только органа, в котором происходит формирование метаболических нарушений, но и сама является органом-мишенью [5, 6, 8]. Основой патогенеза НАЖБП является инсулинорезистентность (ИР) и абдоминальное ожирение (АО), при действии которых в печени пациента повышается синтез жиров, уменьшается окисление свободных жирных кислот, нарушается выведение триглицеридов. В жировой ткани происходит избыточный синтез провоспалительных цитокинов, что, в конечном счете, приводит к повреждению печеночных клеток, развитию воспаления, гибели клеток печени и фиброзу [3, 9]. Прогноз заболевания определяется как прогрессированием патологического процесса в печени, так и увеличением частоты осложнений метаболического синдрома (сахарный диабет, сердечно-сосудистые заболевания) [5, 10]. Зачастую стеатоз печени и стеатогепатит протекают без клинических проявлений, однако постепенно могут прогрессировать в цирроз печени, приводить к печеночной недостаточности и даже к развитию гепатоцеллюлярной карциномы. Практически все компоненты метаболического синдрома являются факторами риска, приводящими к формированию фиброза и цирроза печени [4, 6, 9]. Целью нашего исследования стала оценка состояния печени у пациентов с НАЖБП через 5 лет наблюдения, выявление особенностей прогрессирования патологического процесса в печени у пациентов с ИР. Материалы и методы На базе поликлиники ОАО "Медицина" нами было обследовано 1985 пациентов в возрасте 20-65 лет (1103 мужчины и 882 женщин). Перед включением в исследование все пациенты подписали информированное согласие. Критериями не включения в исследование на первом этапе были: возраст старше 65 лет; ожирение II и III степени (ИМТ свыше 35 кг/м2), диагностированное по критериям ВОЗ (1997 г.); диагностированные ранее нарушения углеводного обмена (критерии ВОЗ 1999-2006 гг.): сахарный диабет 1 и 2 типов и нарушения регуляции глюкозы, требующие лекарственной терапии; диагностированные ранее нарушения липидного обмена (критерии ВНОК, 2007 г.): гипертриглицеридемия свыше 4,5 ммоль/л, врожденные нарушения липидного обмена, прием лекарственных препаратов, регулирующих липидный обмен; диагностированная ранее ишемическая болезнь сердца; диагностированная ранее гипертоническая болезнь, требующая медикаментозной коррекции; прием гормональной заместительной терапии; беременность; тяжелые соматические заболевания в стадии декомпенсации. Проводилось анкетирование с использованием стандартизированных медицинских опросников, включающих необходимые вопросы о состоянии здоровья, наследственности, факторах риска, в том числе курении, приеме алкоголя, физической активности, нарушение пищевого поведения. При оценке курения были использованы критерии американской системы BRFSS (Behavioral Risk Factor Surveillance System), согласно которой все обследованные подразделялись на три категории: курящие; отказавшиеся от курения; никогда не курившие. Согласно критериям физической активности (ФА) по опроснику IPAQ (International Рhysical Аctivity Questionnaire) все пациенты были разделены на 4 категории: физически неактивные, имеющие низкий уровень ФА, имеющие средний уровень ФА, имеющие высокий уровень ФА. При этом под интенсивной физической нагрузкой понимается та, которая длится более 10 мин и приводит к повышению пульса более чем на 20% (плаванье, бег, шейпинг). Для уточнения количества употребляемого алкоголя применяли стандартизированные опросники (опросник AUDIT – Alcohol Use Disorders Identification Test, ВОЗ 1982 г.), рассчитывали количество алкогольных единиц за одну неделю, оценивали уровень риска употребления алкоголя в баллах (1-7 баллов – безопасный, 8-15 баллов – опасный и 16-19 баллов – "вредный" уровень, наносящий ущерб физическому и психическому здоровью). Для оценки пищевого поведения (ПП) был предложен опросник DEBQ (Dutch Eating Behaviour Questionnaire – голландский опросник пищевого поведения). Антропометрическими методами оценивались следующие параметры: рост, масса тела, окружность талии (ОТ). Также рассчитывался индекс массы тела (ИМТ). Критерием абдоминального ожирения являлся объем талии более 94 см у мужчин и более 80 см у женщин (IDF, 2005). По величине ИМТ оценивали нутриционный статус согласно критериям ВОЗ (1997). Исследование лабораторных показателей осуществлялось утром натощак после восьмичасового периода голода. Определяли показатели липидного и углеводного спектра крови: общий холестерин (ОХ), холестерин липопротеидов высокой плотности (XC ЛПВП), холестерин липопротеидов низкой плотности (XC ЛПНП), триглицериды (ТГ), уровень глюкозы и гликозилированного гемоглобина. Исследование иммунореактивного инсулина (ИРИ) натощак проводилось иммуноферментным методом на автоанализаторе. Лабораторная панель оценки функционального состояния печени включала в себя общепринятые показатели, такие как уровень общего билирубина и его фракции, индикаторные ферменты цитолитического синдрома – аланиновая аминотрансфераза (АЛТ) и аспарагиновая аминотрансфераза (АСТ), биохимические маркеры холестаза – щелочная фосфатаза (ЩФ) и гамма-глютамилтранспептидаза (ГГТП). Оценку чувствительности тканей к инсулину проводили с использованием расчетного индекса НОМА-IR, который вычисляли по формуле: 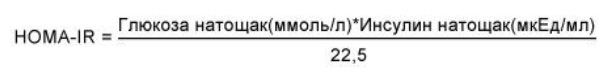 Согласно рекомендациям ВОЗ, в клинической практике для оценки наличия ИР предлагается использовать верхнюю квартиль распределения индекса HOMA-IR в общей популяции. Таким образом, пороговое значение резистентности к инсулину, выраженной в HOMA-IR, определяется как 75 перцентиль его кумулятивного популяционного распределения. В нашем исследовании пороговое значение HOMA составило 2,6 балла. ИР предполагалась при величине HOMA-IR больше 2,6 баллов, значение HOMA-IR менее или равное 2,6 баллам предполагалось у инсулиночувствительных (ИЧ) субъектов. Всем пациентам было выполнено ультразвуковое исследование брюшной полости с целью выявления УЗ-признаков жирового гепатоза. При этом оценивались следующие качественные показатели печени: эхогенность паренхимы печени, звукопроводимость и ангиоархитектоника печени по общепринятой методике. Диагноз НАЖБП устанавливался как диагноз исключения при отсутствии у пациентов других этиологических факторов поражения печени: вирусных гепатитов и циррозов, алкогольного и токсического, в том числе лекарственного, поражения печени, холестатических, аутоиммунных заболеваний печени, болезней накопления и врожденной патологии обмена веществ. Результаты и обсуждение В нашей группе наблюдения при первичном обследовании диагноз НАЖБП был установлен у 281 пациентов: 167 пациентов с ИР+НАЖБП (2 группа) и 114 пациентов с изолированной НАЖБП (3 группа). Пациенты 1 и 4 групп не имели признаков НАЖБП: 1 группа – пациенты с изолированной ИР, пациенты 4 группы – без признаков ИР и НАЖБП. ИР на этапе включения в исследование диагностировалась по индексу HOMA-IR > 2,6 баллов. Через 5 лет наблюдения среди пациентов с изолированной ИР УЗ-признаки НАЖБП появились у 25,0% (49/196) пациентов (16 мужчин и 33 женщины). В контрольной группе признаки НАЖБП были выявлены у 4,6% (7/150) пациентов. Всем пациентам с впервые выявленными признаками жирового гепатоза было назначено дополнительное обследование (маркеры вирусных гепатитов, обмен меди и железа, гамма-глобулины, лекарственный анамнез), по результатам которого были исключены другие причины жирового перерождения печени (рис. 1). Рисунок 1. Формирование НАЖБП и ИР через 5 лет в изучаемых группах 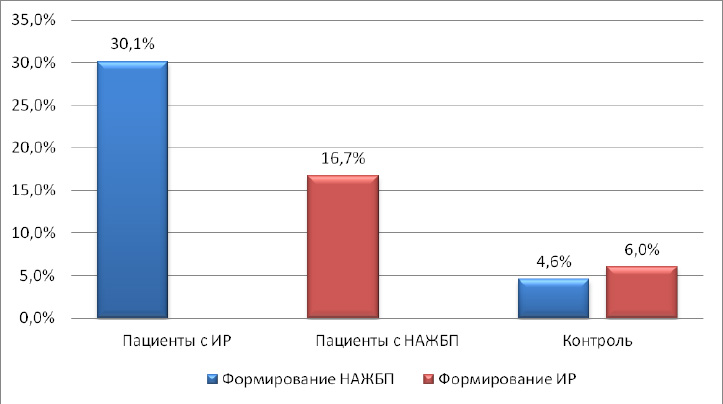 Среди пациентов с изолированной НАЖБП через 5 лет наблюдения индекс НОМА-IR стал > 2,6 (от 2,64 до 6,5) у 16,7% (19/114) пациентов. В группе контроля индекс стал выше нормы лишь у 6,0% (9/150) пациентов, диапазон значений НОМА-IR у этих пациентов составили от 2,61 до 4,1. Таким образом, у пациентов с ИР в 25,0% случаев через 5 лет сформировалась НАЖБП, а у пациентов с НАЖБП ИР сформировалась в 16,7% случаев. При оценке шансов возникновения НАЖБП у пациентов с ИР и ИР у пациентов с НАЖБП был проведен расчет отношения шансов развития данных состояний по сравнению с группой контроля (табл. 1). Таблица 1. Расчет шансов возникновения НАЖБП и ИР в изучаемых группах 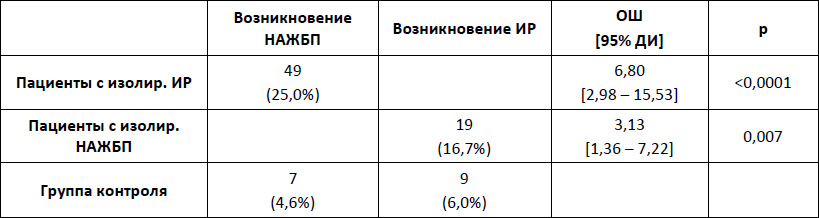 Шансы формирования НАЖБП у пациентов с ИР в 2,2 раза выше, чем формирование ИР у пациентов с НАЖБП в течение 5 лет. При сопоставлении клинических исходов и вновь выявленных НАЖБП и ИР через 5 лет было показано, что в группе с изолированной ИР у 87,9% (29/35) пациентов с клиническими исходами в течение 5 лет появилась признаки НАЖБП. В группе с изолированной НАЖБП у 60,0% (12/20) пациентов с клиническими исходами через 5 лет была диагностирована ИР (по индексу НОМА-IR). В группе контроля в течение 5 лет изолированная ИР сформировалась у 4,7% (7/150) пациентов, ИР+НАЖБП – у 1,3% (2/150), изолированная НАЖБП у 3,3% (5/150) пациентов. Из этих пациентов только у одного – с изолированной ИР – не были выявлены клинические исходы, а у остальных – различные коморбидные состояния. Для оценки прогрессирования стеатогепатита и возможного формирования фиброза в печени из исследуемой группы пациентов с НАЖБП мы исключили пациентов с установленными диагнозами и назначенным лечением (всего 115 пациентов), а также пациентов с вновь выявленными ИР и НАЖБП (всего 28 человек). В дальнейшее обследование были включены 248 пациентов с НАЖБП: группа ИР+НАЖБП 162 пациента, группа с изолированной НАЖБП 87 пациентов. Показатели цитолиза и холестаза При анализе ферментов цитолиза через 5 лет было показано, что средние значения АЛТ достоверно увеличились у пациентов ИР+НАЖБП (р=0,049) и имели тенденцию к увеличению в группе НАЖБП. Средние значения АСТ значимо не менялись у пациентов обеих групп, а у пациентов с изолированной НАЖБП оставались в пределах нормальных значений (табл. 2). Таблица 2. Средние показатели и диапазоны значений аминотрансфераз в группах наблюдения через 5 лет 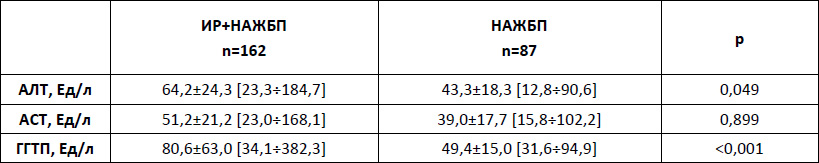 Средний показатель ГГТП был достоверно повышен у пациентов ИР+НАЖБП и составил 80,6±63,0 Ед/л, у пациентов с изолированной НАЖБП средний показатель составил 49,4±15,0 Ед/л (р<0,001). Средние значения ЩФ было в норме во всех группах. Количество пациентов с НАСГ Через 5 лет лабораторные признаки НАСГ (превышение АЛТ и/или АСТ более 1,5 от ВГН) в целом среди пациентов с НАЖБП стали выявляться чаще, чем при первичном обследовании – в 25,3% (63/249) против 22,7% (112/494) случаев соответственно (р=0,431). При этом в группе с ИР+НАЖБП количество пациентов с НАСГ было в 2,7 раза больше, чем в группе с изолированной НАЖБП –18,5% (46/249) против 6,8% (17/249) соответственно (табл. 3). Таблица 3. Клинико-лабораторные формы НАЖБП с изучаемых группах 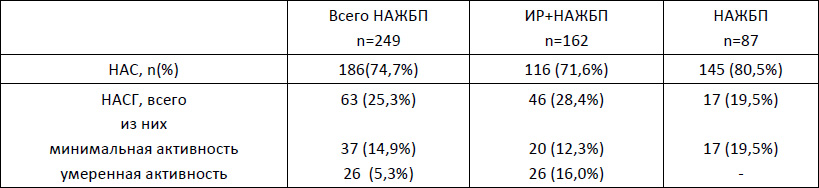 Степень активности НАСГ В группе ИР+НАЖБП среди пациентов с НАСГ (n=46) минимальная степень активности (повышение АЛТ не более 3-х норм) наблюдалась в 43,5% (20/46), умеренная степень активности отмечена в 56,5% (26/46) наблюдений, что достоверно превысило количество пациентов с умеренной активностью НАСГ на этапе включения в исследование – 29,2% (26/89), р=0,004. У пациентов с изолированной НАЖБП повышение активности трансаминаз не превышало 3-х норм у всех пациентов с НАСГ (n=17), умеренной степени активности не было выявлено. Высокой степени активности с повышением трансаминаз более 10 норм в нашем исследовании ни у одного пациента не было выявлено. Вывод Таким образом, шансы формирования НАЖБП у пациентов с ИР более чем в 2 раза выше, чем формирование ИР у пациентов с НАЖБП. В течение 5 лет наблюдения в нашей группе среди пациентов с ИР+НАЖБП достоверно выше стали средние показатели АЛТ, появилась тенденция к увеличению встречаемости клинико-лабораторной формы стеатогепатита, а также достоверно чаще стала встречаться умеренно выраженная активность НАСГ. Список литературы 1. Драпкина О.М, Гацолаева Д.С., Ивашкин В.Т. Неалкогольная жировая болезнь печени как компонент метаболического синдрома // Российские медицинские вести. – 2010. – №2. – С.72-8. 2. Звенигородская Л.А. Неалкогольная жировая болезнь печени: эволюция представлений // Эффективная фармакотерапия. – 2015. – № 2. – С. 16-22. 3. Комшилова К.А., Трошина Е.А. Ожирение и неалкогольная жировая болезнь печени: метаболические риски и их коррекция // Ожирение и метаболизм. – 2015. – Т.12. №2. – С. 35-39. 4. Никитин И.Г. Скрининговая программа по выявлению распространенности неалкогольной жировой болезни печени и определению факторов риска развития заболевания // Российские медицинские вести. – 2010. – Т. 15. № 1. – С. 41-46. 5. Ройтберг Г.Е., Дорош Ж.В., Шархун О.О. Влияние инсулинорезистентности на формирование и прогрессирование компонентов метаболического синдрома (итоги пятилетнего исследования) // Рациональная фармакотерапия в кардиологии. – 2015. – Т.11. № 2 – С. 132-138. 6. Стаценко М.Е., Туркина С.В., Косивцова М.А., Тыщенко И.А. Неалкогольная жировая болезнь печени как мультисистемное заболевание // Вестник Волгоградского государственного медицинского университета. – 2016. – № 2 (58). – С. 8-14. 7. Трухан Д.И., Иванова Д.С. Неалкогольная жировая болезнь печени, ассоциированная с ожирением: терапевтические возможности. // Consilium Medicum. – 2016. – Т.18. №8. – С .31-34. 8. Chalasani, N. The diagnosis and management of non-alcoholic fatty liver disease: practice guideline by the American Gastroenterological Association, American Association for the Study of Liver Diseases, and American College of Gastroenterology / N. Chalasani, Z. Younossi, J. E. Lavine, A. M. Diehl, E. M. Brunt, K. Cusi, M. Charlton, A. J. Sanyal // Gastroenterology. – 2012. – Vol. 142. – P. 1592–1609. 9. Satapathy, S. K. Epidemiology and Natural History of Nonalcoholic Fatty Liver Disease / S. K. Satapathy, A.J. Sanyal // Semin Liver Dis. – 2015. – Vol. 35(3). – P. 221-35. 10. Targher G, Marra F, Marchesini G. Increased risk of cardiovascular disease in non-alcoholic fatty liver disease: causal effect or epiphenomenon? // Diabetologia. – 2008. – Vol.51(11). – Р.1947-53.
Corresponding author Sharkhun O.O., E-mail: olga_sharkhun@mail.ru Abstract The article assesses the state of the liver in patients with nonalcoholic fatty liver disease (NAFLD) after 5 years of follow up. We tried to identify the progression features of the pathological process in the liver in insulin resistant patients. NAFLD is considered in close association with the metabolic syndrome, based on insulin resistance (IR) phenomenon. We presented clinical outcomes of NAFLD within 5 years in patients with and without IR, as well as the development of IR in NAFLD patients. Among patients with NAFLD within 5 years of follow up we estimated steatosis to steatohepatitis transformation, as well as the degree of steatohepatitis activity on clinical and laboratory data. Key words fatty liver, steatohepatitis, insulin resistance, risk factors, abdominal obesity, questionnaires, patient physical activity References 1. Drapkina, O. M., D. S. Gapolaeva, and V. T. Ivashkin. "Non-alcoholic fatty liver disease as a component of the metabolic syndrome." Rossijskie medicinskie vesti, no. 2 (2010): 72-78. 2. Zvenigorodskaya, L. A. "Non-alcoholic fatty liver disease: the evolution of concepts." Effektivnaya farmakoterapiya, no. 2 (2015): 16-22. 3. Komshilova, K. A., and E. A. Troshina. "Obesity and non-alcoholic fatty liver disease: metabolic risks and their correction." Ozhirenie i metabolizm 12, no. 2 (2015): 35-39. 4. Nikitin, I. G. "Screening program to identify the prevalence of non-alcoholic fatty liver disease and determine the risk factors for the development of the disease." Rossijskie medicinskie vesti 15, no. 1 (2010): 41-46. 5. Roytberg, G. E., Z. V. Dorosh, and O. O. Sharkhun. "Influence of insulin resistance on the formation and progression of components of the metabolic syndrome (the results of a five-year study)." Racional'naya farmakoterapiya v kardiologii 11, no. 2 (2015): 132-38. 6. Stacenko, M. E., S. V. Turkina, M. A. Kosivcova, and I. A. Tyshchenko. "Nonalcoholic fatty liver disease as a multisystem disease." Vestnik Volgogradskogo gosudarstvennogo medicinskogo universiteta 58, no. 2 (2016): 8-14. 7. Truhan, D. I., and D. S. Ivanova. "Non-alcoholic fatty liver disease associated with obesity: therapeutic options." Consilium Medicum 18, no. 8 (2016): 31-34. 8. Chalasani, Naga, Zobair Younossi, Joel E. Lavine, Anna Mae Diehl, Elizabeth M. Brunt, Kenneth Cusi, Michael Charlton, and Arun J. Sanyal. "The Diagnosis and Management of Non-alcoholic Fatty Liver Disease: Practice Guideline by the American Gastroenterological Association, American Association for the Study of Liver Diseases, and American College of Gastroenterology." Gastroenterology 142, no. 7 (2012): 1592-609. doi:10.1053/j.gastro.2012.04.001. 9. Satapathy, Sanjaya, and Arun Sanyal. "Epidemiology and Natural History of Nonalcoholic Fatty Liver Disease." Seminars in Liver Disease 35, no. 03 (2015): 221-35. doi:10.1055/s-0035-1562943. 10. Targher, G., F. Marra, and G. Marchesini. "Increased risk of cardiovascular disease in non-alcoholic fatty liver disease: causal effect or epiphenomenon?" Diabetologia 51, no. 11 (2008): 1947-953. doi:10.1007/s00125-008-1135-4. |
[ См. также ] Рубрики |
||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|