| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Примеси нитрозаминов в лекарственных препаратах: пути образования и механизмы токсического действия
Автор для корреспонденции: Хорольский Михаил Дмитриевич, e-mail: mkhorolski@gmail.com. Финансирование: Исследование не имело спонсорской поддержки. Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов. Аннотация В настоящем обзоре были установлены основные источники образования нитрозаминов в лекарственных препаратах на всех стадиях обращения, а также основной механизм токсического действия данной группы примесей на организм человека. Причиной повышенного содержания нитрозаминов в препаратах группы сартанов является использование в процессе производства азотистой кислоты, которая при взаимодействии с распространенными органическими растворителями, содержащими аминогруппу, может образовывать токсические соединения. Помимо этого примеси нитрозаминов могут образовываться в процессе деградации основного или вспомогательных веществ. Итогами обзора являются выводы о необходимости дальнейшего изучения путей образования и механизма токсичности, а также разработки методик их определения в фармацевтических субстанциях и лекарственных препаратах. Ключевые слова генотоксичные примеси, нитрозамины, валсартан doi: 10.29234/2308-9113-2019-7-4-12-24 Для цитирования: Хорольский М.Д., Чапленко А.А., Власов А.М., Масленникова Н.В., Раменская Г.В. Примеси нитрозаминов в лекарственных препаратах: пути образования и механизмы токсического действия. Медицина 2019; 7(4): 12-24. Введение В начале 2018 года мировой фармацевтический рынок впервые столкнулся с проблемой содержания генотоксичных примесей нитрозаминов (N-нитрозодиметиламина (NDMA) и N-нитрозодиэтиламина (NDEA)) в фармацевтических субстанциях. Новость об обнаружении органами регулирования обращения лекарственных средств ЕС и США, многократно превышающего допустимый уровень этих примесей в фармацевтической субстанции валсартана производства Zhejiang Huahai Pharmaceutical (КНР), стала неожиданной, ранее содержанию данных примесей не уделялось столь пристального внимания. Вскоре после этого FDA и EMA объявило об отзыве препаратов, содержащих субстанцию вышеназванного производителя, а в марте 2019 года FDA обнаружило высокий уровень другой генотоксической примеси нитрозаминов − N-нитрозо-аминобутановой кислоты (НМБА) − в лозартане производства компании Hetero Labs (Индия) с последующим отзывом сертификата на субстанцию. Полная хронология действий регулятора представлена на официальном сайте организации [1]. В сентябре 2019 года на основании информации от внешней лаборатории американский регулятор объявил об обнаружении токсического уровня NDMA в препарате ранитидина Zantac [2]. По результатам проверок препараты ранитидина, произведенные из субстанции компании Saraca Laboratories Limited (Индия) были в принудительном порядке отозваны EMA, однако позже американские эксперты объяснили полученные результаты завышением уровня примеси в связи с некорректной пробоподготовкой в процессе испытаний. В результате "обвинения" с препарата были сняты, однако репутационные потери, понесенные производителями и дистрибьюторами ранитидина, остались некомпенсированными. Несмотря на значительный интерес медицинского и фармацевтического сообщества к вышеописанной проблеме, а также проведение всесторонних расследований ведущими регуляторами, вопросы появления примесей нитрозаминов в лекарствах, а также их истинного уровня токсичности, остаются до конца не освещенными. В настоящей работе проведен анализ всех потенциальных источников появления примесей нитрозаминов в лекарственных препаратах (ЛП), а также приведена объективная оценка уровня токсичности данных примесей по данным опубликованных исследований. Источники примесей нитрозаминов в ЛП Нитрозамины – класс соединений, содержащих нитрозогруппу при диалкилзамещенной аминогруппе. Канцерогенность N-нитрозаминов хорошо изучена; выявлено, что приблизительно 90% соединений N-нитрозаминов являются канцерогенными для некоторых видов животных [3]. Подходы к минимизации и обнаружению нитрозаминов в косметической и пищевой продукциях определены в соответствующих стандартах [4,5]. Однако конкретные соединения класса нитрозаминов, детектируемые в ЛП, отличаются от таковых в косметической продукции (рис. 1). Таким образом, требуется разработка новых подходов к оценке риска образования и детектирования данных токсинов в фармацевтической продукции. Рис. 1. Формулы нитрозопроизводных, обнаруженных в лекарственных средствах. 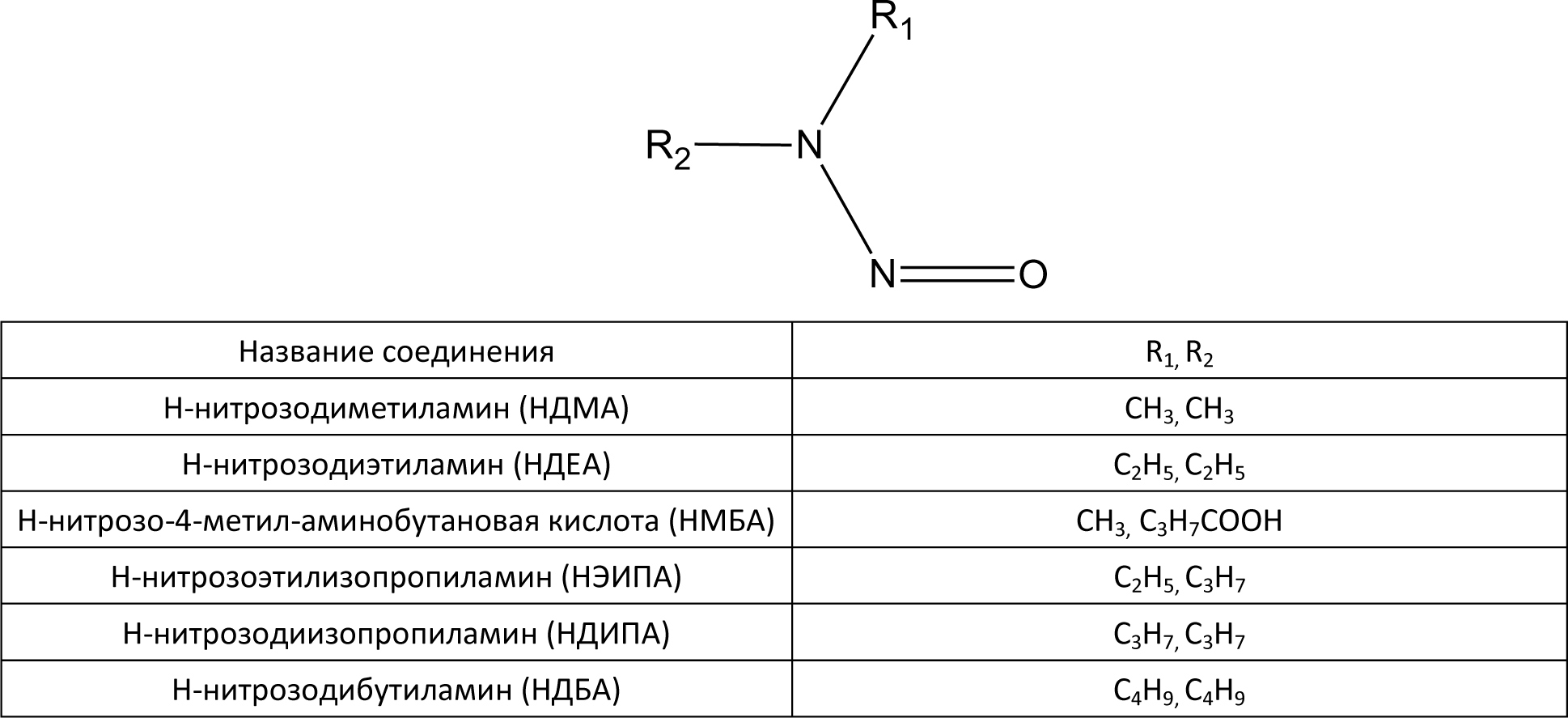 На основе исследований препаратов сартанового ряда и ранитидина регуляторным органом ЕС было разработано руководство, в котором содержится информация о примеси нитрозаминов для производителей лекарственных препаратов [6]. В руководстве также описываются пути образования нитрозаминов: ● использование нитрита натрия (NaNO2) или других нитрозативных соединений в синтезе; ● использование загрязненных сырьевых материалов (растворителей, реагентов и катализаторов) в синтезе фармацевтической субстанции; ● регенерация растворителей, реагентов и катализаторов в процессе синтеза; ● использование контаминированных исходных материалов (ненадлежащий контроль вендоров); ● перекрестная контаминация от перекрестно протекающих процессов синтеза; ● деградация исходных материалов, промежуточных продуктов или лекарственных веществ; ● использование определенных видов упаковки (отмечена контаминация готового препарата, упакованного в блистер; по мнению держателя разрешения на продажу, покрывающая фольга, содержащая нитроцеллюлозный праймер, могла прореагировать с аминами в чернилах с образованием нитрозаминов, которые могли быть перенесены в препарат при определенных условиях упаковки). Описанные выше пути образования нитрозаминов целесообразно классифицировать на три группы: 1) образование в ходе синтеза действующего/вспомогательного вещества; 2) родственные примеси, образующиеся в процессе деградации действующего/вспомогательного вещества; 3) иные пути образования (образование нитрозаминов при попадании ранитидина в организм и взаимодействие первичной упаковки препарата и чернил, содержащих амины). Образование нитрозаминов при синтезе ЛП Образование нитрозаминов в ходе синтеза фармацевтической субстанции является одной из причин их завышенного содержания в ЛП. Увеличение содержания примеси нитрозаминов в препаратах сартанов может являться следствием оптимизации их схемы синтеза. Изменение схемы синтеза, как правило, происходит за счет использования более доступных реагентов, а также сокращения промежуточных этапов синтеза (объединения нескольких стадий в одну или др.). Классическая схема синтеза валсартана происходит путем орто-метилирования 5-фенил-1-тритил-тетразола с N-бутил-литием при 25 ºC в присутствии хлорида цинка [7]. При оптимизации схемы данная стадия заменяется реакцией образования тетразольного кольца с участием азида натрия [8]. Стадия образования тетразольного кольца в улучшенной схеме синтеза валсартана изображена на рис.2. Рис. 2. Образование тетразольного кольца в улучшенной схеме синтеза валсартана. 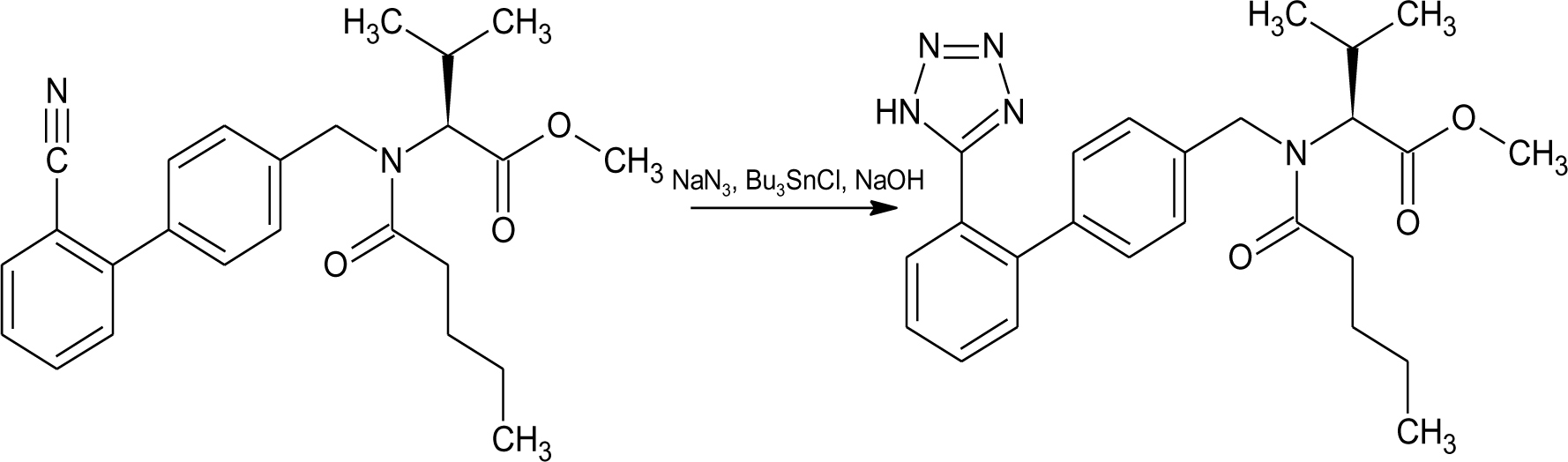 Азид натрия, используемый в синтезе, является взрывоопасным веществом и его остаточные количества должны быть деактивированы на производстве путем добавления азотистой кислоты [9]. Остаточные количества нитрит-ионов могут взаимодействовать с диметиламином (продукт разложения N,N-диметилформамида, промежуточного реагента синтеза) в кислой среде. Образование примеси НДМА в ходе синтеза фармацевтической субстанции лозартана предположительно происходит при одновременном присутствии в реакционной смеси следующих реагентов: нитрит-ионы, диметиламин, азотистая кислота [10]. НДЕА в свою очередь образуется в реакционной смеси, содержащей диэтиламин (примесь к триэтиламина гидрохлориду, распространенному органическому растворителю) и нитрит-ионы в кислой среде. Одинаковые стадии синтеза субстанций лозартана и валсартана обуславливают одинаковый механизм образования примесей НДМА и НДЕА. Примесь НМБА может образовываться путем гидролиза N-метилпирролидона (используемого в синтезе растворителя) до 4-метиламинобутирата натрия в щелочных условиях и последующего взаимодействия получаемого вторичного амина с азотистой кислотой. Реакции образования описанных выше примесей нитрозопроизводных в ходе синтеза фармацевтических субстанций валсартана и лозартана приведены на рис. 3. Рис. 3. Предположительный механизм образования нитрозаминов в ходе синтеза фармацевтических субстанций валсартана и лозартана. 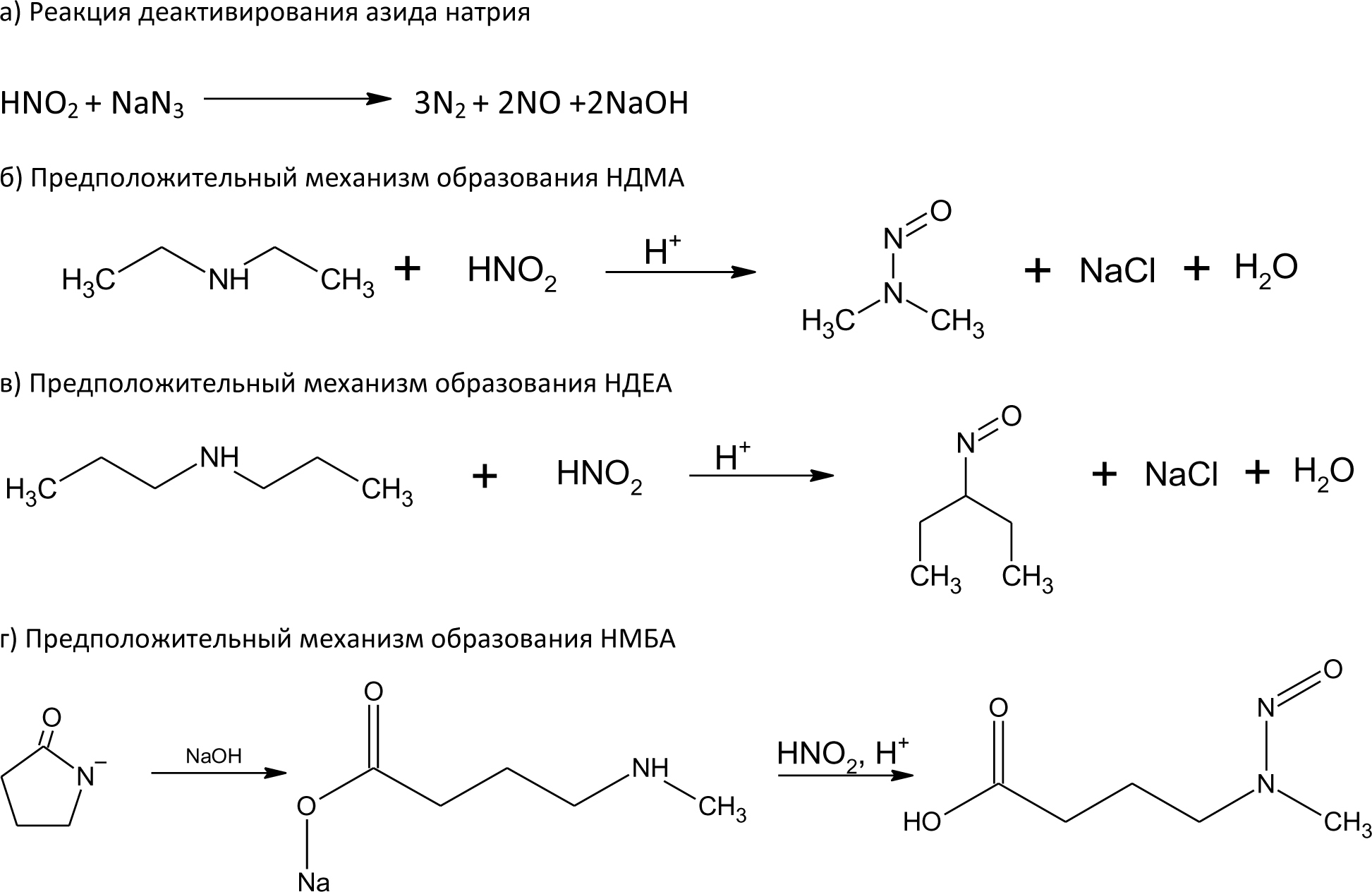 Таким образом, образование примесей нитрозаминов предположительно происходит на завершающей стадии оптимизированной схемы синтеза (в ходе образования тетразольного кольца) при добавлении азида натрия. Для предотвращения образования примесей нитрозаминов необходимо избегать данной стадии, либо добавлять дополнительные этапы очистки, которые в свою очередь, должны быть направлены как на очистку реактивов (растворители от примесей аминов), так и на очистку препарата от образовавшейся примеси. Образование нитрозаминов при хранении ЛП Нитрозамины могут образовываться не только в процессе синтеза фармацевтической субстанции, но и в результате разложения (деградации) действующего или вспомогательного вещества при хранении препарата. Квалификация родственных примесей (идентификация, определение и проведение исследований по безопасности) и валидация соответсвующих аналитических методик происходит на стадии разработки препарата, в т.ч. в процессе оценки стабильности. Методология проведения исследований стабильности описывается как в международном руководстве ICH Q1A (R2) так и в ГФ РФ ОФС.1.1.0009.15 (Сроки годности лекарственных средств). Поскольку риск образования родственных примесей нитрозаминов прямо зависит от структуры молекулы действующего вещества, целесообразно выделить соединения с наибольшей вероятностью физико-химической деградации с образованием соединений данного класса. Уровень риска образования нитрозаминов при хранении предсказуемо максимален для веществ, содержащих амино- (за исключением четвертичных аминов) и нитрогруппы [11]. Данная гипотеза согласуется с фактическими данными по обнаружению примесей нитрозаминов в фармацевтических субстанциях. Структуры молекул всех действующих веществ, в которых в качестве родственных примесей были обнаружены нитрозамины, содержат вышеуказанные функциональные группы (рис. 4) [12,13,14]. Рис. 4. Структуры молекул действующих веществ в фармацевтических субстанциях, в которых были обнаружены примеси нитрозаминов. 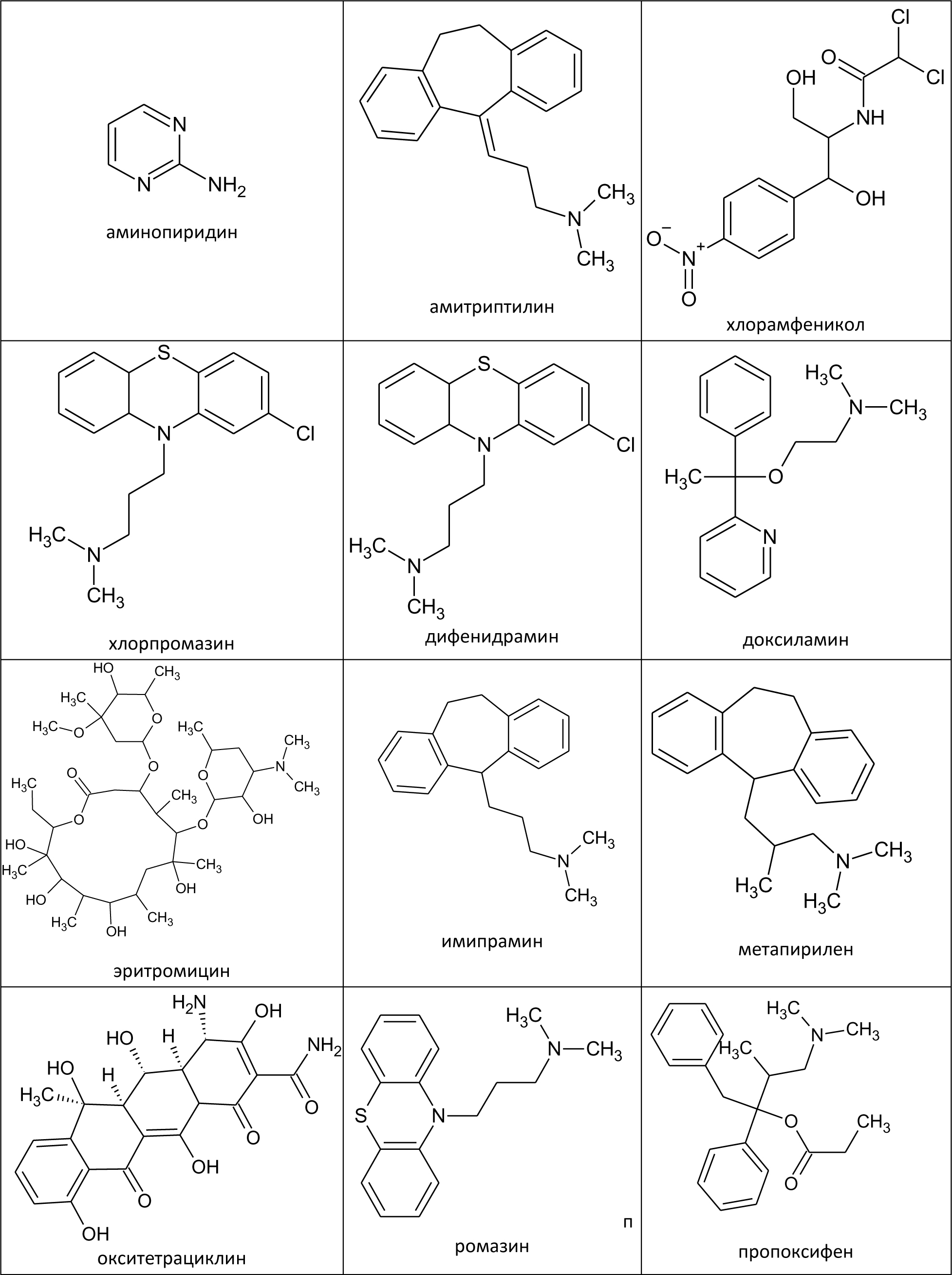 Иные пути образования нитрозаминов и управление рисками В руководстве EMA также описывается путь образования нитрозаминов при воздействии желудочного сока на таблетку препарата (ранитидин), а также при взаимодействии первичной упаковки препарата, состоящей из нитроцеллюлозы и чернил, содержащих амины. Данные пути образования нитрозаминов являются в большей степени гипотетическими, нежели имеющими место в реальной практике. Несмотря на это, следует контролировать даже минимальные риски образования нитрозаминов в ЛП, поскольку медикаменты в большинстве случаев применяются у ослабленных заболеванием индивидов, многие препараты предполагают курсовой прием на протяжении месяцев, лет или всей жизни пациента (препараты сартанов). Европейским и американским регулятором были описаны принципы и подходы, которые должны применяться для предотвращения и контроля образования нитрозаминов. Основным подходом является определение теоретического риска образования нитрозаминов в ЛС. Данный подход называется риск-основанным и заключается в исследовании всех аспектов, связанных с производством, оборотом и применением ЛС. В то же время уровень риска связан с возможным механизмом токсического действия нитрозаминов и уровня допустимой концентрации. Методология риск-основанного подхода описана в руководстве ICH Q9 Guideline on quality risk management. Механизмы токсического действия Одним из основных токсических воздействий, которое оказывают нитрозамины на организм является их генотоксичность. Генотоксичность – способность веществ воздействовать на структуру ДНК или нарушать процесс ее репликации [15]. Очевидной опасностью веществ с потенциальной генотоксичностью является их способность оказывать мутагенное и канцерогенное действие вне зависимости от концентрации, попавшей в организм. Кроме того, вышеописанные примеси накапливаются в клетках печени, выделяются с желчью и, как следствие, оказывают токсическое воздействие на гепатобилиарную систему [16]. Несмотря на то, что примеси N-нитрозопроизводных изучаются с 80-х годов прошлого века, точный механизм оказания генотоксичности до сих пор не установлен. Согласно опубликованным данным, предположительный механизм генотоксичности нитрозопроизводных заключается в алкилировании ДНК [17]. В различных источниках сообщается, что нативные соединения нитрозаминов не оказывают генотоксического воздействия, однако в ходе их метаболизма происходит образование алкилирующих агентов, изменяющих структуру ДНК. Механизм генотоксического действия НДМА представлен на рис. 5. Рисунок 5. Механизм генотоксического действия НДМА 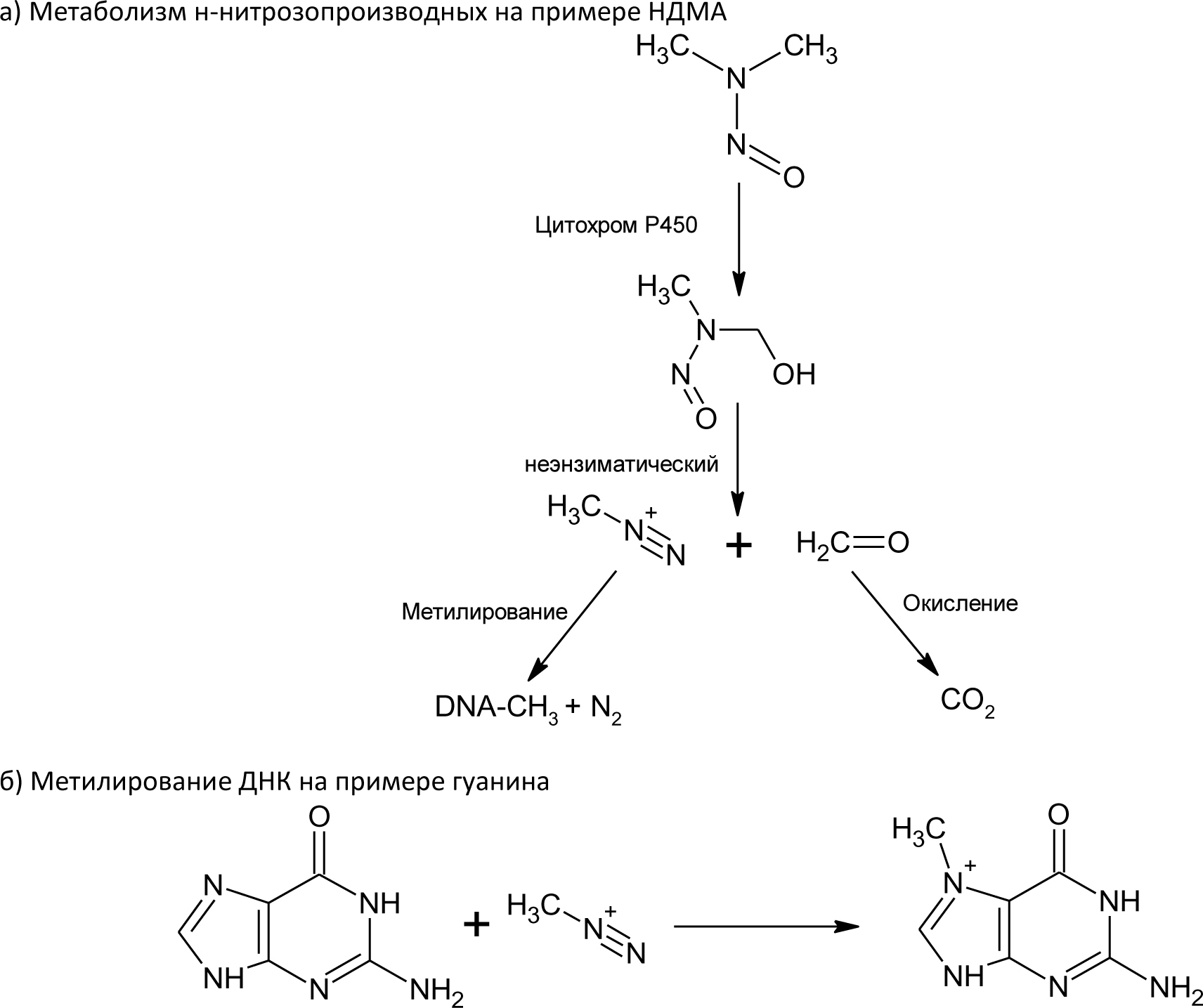 Основной механизм генотоксичности НДМА реализуется за счет взаимодействия иона метилдиазония (который образуется в результате метаболизма нитрозаминов) с ДНК [18]. Образование формальдегида в ходе метаболизма опосредует гепатотоксическое действие НДМА [19]. Кумуляция нитрозопроизводных соединений в печени приводит к постоянному повреждающему воздействию, которое с большой вероятностью вызывает малигнизацию клеток. В руководстве EPA IRIS примеси нитрозопроизводных относятся к категории 2А, которая классифицирует их как вещества "вероятно канцерогенные для человека". Термин "вероятно канцерогенные" означает, что исследования на людях не проводились ввиду соблюдения этических норм, а исследования на крысах (стандартный тест) показал высокую генотоксичность [20]. Ведущими мировыми регуляторными органами (EMA, FDA) установлены предельно допустимые концентрации (ПДК) в фармацевтических субстанциях. Заключение В настоящем обзоре были установлены основные источники образования нитрозаминов в ЛП на всех стадиях обращения, а также основной механизм токсического действия данной группы примесей на организм человека. Причиной повышенного содержания нитрозаминов в препаратах группы сартанов является использование в процессе производства азотистой кислоты, которая при взаимодействии с распространенными органическими растворителями, содержащими аминогруппу, может образовывать токсические соединения. Помимо этого, примеси нитрозаминов могут образовываться в результате деградации основного или вспомогательных веществ ЛП. Соединения, содержащие аминогруппу (за исключением четвертичных аминов) могут быть склонны к деградации с образованием генотоксичных нитрозаминов. Высокая биологическая активность нитрозаминов обуславливает необходимость оценки потенциального риска генотоксичности, связанной даже с весьма незначительными количествами, образующимися в результате взаимодействий упаковки ЛП, содержащей фрагменты химической структуры нитроцеллюлозы и чернилами, используемыми для маркировки ЛП, в формуле которых может присутствовать аминогруппа. Таким образом, потенциальное присутствие примесей нитрозаминов в ЛП является серьезной проблемой фармацевтического производства, требующей для своего решения, с одной стороны, всестороннего анализа рисков, с другой – разработки современных высокочувствительных и точных методик оценки качества. Список литературы 1. FDA Updates and Press Announcements on Angiotensin II Receptor Blocker (ARB) Recalls (Valsartan, Losartan, and Irbesartan). URL: https://www.fda.gov/drugs/drug-safety-and-availability/fda-updates-and-press-announcements-angiotensin-ii-receptor-blocker-arb-recalls-valsartan-losartan (дата обращения: 20.11.2019). 2. Statement alerting patients and health care professionals of NDMA found in samples of ranitidine. FDA. URL: https://www.fda.gov/news-events/press-announcements/statement-alerting-patients-and-health-care-professionals-ndma-found-samples-ranitidine (дата обращения: 20.11.2019). 3. Magee P.N. Nitrosamines and human cancer: Introduction and overview. European Journal of Cancer Prevention 1996; (5): 7-10. 4. Межгосударственный стандарт ГОСТ ISO/TR 14735-2015 Продукция косметическая. Аналитические методы. Техническое руководство по минимизации и обнаружению N-нитрозаминов. URL: http://docs.cntd.ru/document/1200124576 (дата обращения: 20.11.2019). 5. МУК 4.4.1.011-93 Определение летучих N-нитрозаминов в продовольственном сырье и пищевых продуктах URL: http://docs.cntd.ru/document/1200031689 (дата обращения: 20.11.2019). 6. European Medicines Agency. Questions and answers on "Information on nitrosamines for marketing authorisation holders." URL: https://www.ema.europa.eu/en/documents/referral/nitrosamines-emea-h-a53-1490-questions-answers-information-nitrosamines-marketing-authorisation_en.pdf (дата обращения 20.11.2019). 7. Chen X.Z., Guo J.Z., Fu Q.B., Yu L.L. A simple and efficient synthesis of the valsartan. Chinese Chemical Letters 2008; 19 (7): 759-761. doi: 10.1016/j.cclet.2008.04.032 8. Ghosh S., Kumar A.S., Soundararajan R., Mehta G.N. Improved Synthesis of Valsartan via Nucleophilic Aromatic Substitution on Aryloxazoline. Synthetic Communications 2009; 39 (21): 3880-3887. doi: 10.1080/00397910902840819 9. Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council. Prudent practices in the laboratory: handling and disposal of chemicals. National Academy Press, 1995. ISBN 0309052297. 10. Masada S., Tsuji G., Arai R., Uchiyama N., Demizu Y., Tsutsumi T., Yasuhiro A., Hiroshi A., Takashi H., Ken-ichi I., Yukihiro G., Okuda, H. Rapid and efficient high-performance liquid chromatography analysis of N-nitrosodimethylamine impurity in valsartan drug substance and its products. Scientific Reports 2019; 9, 11852. doi: 10.1038/s41598-019-48344-5 11. Wang X., Yang H., Zhou B., Wang X., Xie Y. Effect of oxidation on amine-based pharmaceutical degradation and N-Nitrosodimethylamine formation: Water Research 2015; (87): 403-411. doi: 10.1016/j.watres.2015.07.045 12. Juan L., Na L., Characterization of seven psychoactive pharmaceuticals as N-nitrosodimethylamine precursors during free chlorine and chlorine dioxide chlorination processes. Journal of Chemical Technology & Biotechnology 2018; 94 (1): 53-62. doi: 10.1002/jctb.5755 13. Shen R., Andrews S.A. Demonstration of 20 pharmaceuticals and personal care products (PPCPs) as nitrosamine precursors during chloramine disinfection. Water Research 2011; 45 (2): 944-952. doi: 10.1016/j.watres.2010.09.036 14. Parr M.K., Joseph J.F. NDMA Impurity in Valsartan and other Pharmaceutical Products: Analytical Methods for the Determination of N-Nitrosamines. Journal of Pharmaceutical and Biomedical Analysis 2018; 164: 536-549 doi: 10.1016/j.jpba.2018.11.010 15. Brendler S.Y., Tompa A., Hutter K.F., Preussmann R., Pool-Zobel B.L. In vivo and in vitro genotoxicity of several N-nitrosamines in extrahepatic tissues of the rat. Carcinogenesis 1992; 13 (12): 2435-2441. 16. Sheweita S.A., El Banna Y.Y., Balbaa M., Abdullah I.A., Hassan H.E. N-nitrosamines induced infertility and hepatotoxicity in male rabbits. Environ. Toxicol. 2017; 32 (9): 2212-2220. doi: 10.1002/tox.22436. 17. George J., Tsuchishima M., Tsutsumi M. Molecular mechanisms in the pathogenesis of N-nitrosodimethylamine induced hepatic fibrosis. Cell Death and Disease 2019; 10 (18) doi: 10.1038/s41419-018-1272-8 18. Allis, J.W., Brown, B.L., Simmons, J.E., Hatch, G.E., McDonald, A., House, D.E. Methanol potentiation of carbon tetrachloride hepatotoxicity: The central role of cytochrome P450. Toxicology 1996; 112 (2), 131-140. doi: 10.1016/0300-483x(96)03366-5 19. Madden J.W., Gertman P.M., Peacock E.E. Dimethylnitrosamine-induced hepatic cirrhosis: a new canine model of an ancient human disease. Surgery 1970; 68 (1): 260-268. 20. Integrated Risk Information System (IRIS) U.S. Environmental Protection Agency. Chemical Assesment Summary. National Center for Environment Assesment. URL: https://cfpub.epa.gov/ncea/iris/iris_documents/documents/subst/0045_summary.pdf Accessed: 22.11.2019
Corresponding Author: Khorolskiy Mikhail; e-mail: mkhorolski@gmail.com. Conflict of interest. None declared. Funding. The study had no sponsorship. Abstract In the review, the main sources of the nitrosamines formation in drugs were established, as well as the main mechanism of the toxic effect of this impurities group on the human body. The reason of the increased nitrosamines content in the group of sartan drugs is the use of nitrous acid in the manufacturing process. Nitrous acid interacts with common organic solvents, that contain an amino group, forming toxic compounds. Moreover, impurities of nitrosamines can be formed during the degradation of the principal or auxiliary substances. The results of the review are conclusions about the necessity of further studies of the formation pathways and the toxicity mechanism, besides the development of methods for their determination in pharmaceutical substances and drugs. Key words genotoxic impurities, nitrosamines, valsartan References 1. FDA Updates and Press Announcements on Angiotensin II Receptor Blocker (ARB) Recalls (Valsartan, Losartan, and Irbesartan). URL: https://www.fda.gov/drugs/drug-safety-and-availability/fda-updates-and-press-announcements-angiotensin-ii-receptor-blocker-arb-recalls-valsartan-losartan Accessed: 20.11.2019 2. Statement alerting patients and health care professionals of NDMA found in samples of ranitidine. FDA. URL: https://www.fda.gov/news-events/press-announcements/statement-alerting-patients-and-health-care-professionals-ndma-found-samples-ranitidine Accessed: 20.11.2019 3. Magee P.N. Nitrosamines and human cancer: Introduction and overview. European Journal of Cancer Prevention 1996; (5): 7-10. 4. Mezhgosudarstvennyj standart GOST ISO/TR 14735-2015 Produkciya kosmeticheskaya. Analiticheskie metody. Tekhnicheskoe rukovodstvo po minimizacii i obnaruzheniyu N-nitrozaminov [Interstate Standard ISO/TR 14735:2013, Cosmetics. Analytical methods. Nitrosamines: Technical guidance document for minimizing and determining N-nitrosamines in cosmetics]. URL: http://docs.cntd.ru/document/1200124576 Accessed: 20.11.2019. (In Russ.) 5. MUC. 4.4.1.011-93. Opredelenie letuchih N-nitrosaminov v prodovol’stvennom sir’e I pishevih productah [Metodic Control Guidelines 4.4.1.011-93. Detection of volatile N-nitrosamines in food raw materials and food products]/ URL: http://docs.cntd.ru/document/1200031689 Accessed: 22.11.2019 (In Russ.) 6. European Medicines Agency. Questions and answers on "Information on nitrosamines for marketing authorisation holders." URL: https://www.ema.europa.eu/en/documents/referral/nitrosamines-emea-h-a53-1490-questions-answers-information-nitrosamines-marketing-authorisation_en.pdf Accessed: 22.11.2019 7. Chen X.Z., Guo J.Z., Fu Q.B., Yu L.L. A simple and efficient synthesis of the valsartan. Chinese Chemical Letters 2008; 19 (7): 759-761. doi: 10.1016/j.cclet.2008.04.032 8. Ghosh S., Kumar A.S., Soundararajan R., Mehta G.N. Improved Synthesis of Valsartan via Nucleophilic Aromatic Substitution on Aryloxazoline. Synthetic Communications 2009; 39 (21): 3880-3887. doi: 10.1080/00397910902840819 9. Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council. Prudent practices in the laboratory: handling and disposal of chemicals. National Academy Press, 1995. ISBN 0309052297. 10. Masada S., Tsuji G., Arai R., Uchiyama N., Demizu Y., Tsutsumi T., Yasuhiro A., Hiroshi A., Takashi H., Ken-ichi I., Yukihiro G., Okuda, H. Rapid and efficient high-performance liquid chromatography analysis of N-nitrosodimethylamine impurity in valsartan drug substance and its products. Scientific Reports 2019; 9, 11852. doi: 10.1038/s41598-019-48344-5 11. Wang X., Yang H., Zhou B., Wang X., Xie Y. Effect of oxidation on amine-based pharmaceutical degradation and N-Nitrosodimethylamine formation: Water Research 2015; (87): 403-411. doi: 10.1016/j.watres.2015.07.045 12. Juan L., Na L., Characterization of seven psychoactive pharmaceuticals as N-nitrosodimethylamine precursors during free chlorine and chlorine dioxide chlorination processes. Journal of Chemical Technology & Biotechnology 2018; 94 (1): 53-62. doi: 10.1002/jctb.5755 13. Shen R., Andrews S.A. Demonstration of 20 pharmaceuticals and personal care products (PPCPs) as nitrosamine precursors during chloramine disinfection. Water Research 2011; 45 (2): 944-952. doi: 10.1016/j.watres.2010.09.036 14. Parr M.K., Joseph J.F. NDMA Impurity in Valsartan and other Pharmaceutical Products: Analytical Methods for the Determination of N-Nitrosamines. Journal of Pharmaceutical and Biomedical Analysis 2018; 164: 536-549 doi: 10.1016/j.jpba.2018.11.010 15. Brendler S.Y., Tompa A., Hutter K.F., Preussmann R., Pool-Zobel B.L. In vivo and in vitro genotoxicity of several N-nitrosamines in extrahepatic tissues of the rat. Carcinogenesis 1992; 13 (12): 2435-2441. 16. Sheweita S.A., El Banna Y.Y., Balbaa M., Abdullah I.A., Hassan H.E. N-nitrosamines induced infertility and hepatotoxicity in male rabbits. Environ. Toxicol. 2017; 32 (9): 2212-2220. doi: 10.1002/tox.22436 17. George J., Tsuchishima M., Tsutsumi M. Molecular mechanisms in the pathogenesis of N-nitrosodimethylamine induced hepatic fibrosis. Cell Death and Disease 2019; 10 (18) doi: 10.1038/s41419-018-1272-8 18. Allis, J.W., Brown, B.L., Simmons, J.E., Hatch, G.E., McDonald, A., House, D.E. Methanol potentiation of carbon tetrachloride hepatotoxicity: The central role of cytochrome P450. Toxicology 1996; 112 (2), 131-140. doi: 10.1016/0300-483x(96)03366-5 19. Madden J.W., Gertman P.M., Peacock E.E. Dimethylnitrosamine-induced hepatic cirrhosis: a new canine model of an ancient human disease. Surgery 1970; 68 (1): 260-268. 20. Integrated Risk Information System (IRIS) U.S. Environmental Protection Agency. Chemical Assesment Summary. National Center for Environment Assesment. URL: https://cfpub.epa.gov/ncea/iris/iris_documents/documents/subst/0045_summary.pdf Accessed: 22.11.2019 |
[ См. также ] Рубрики |
||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|