| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Эффективность и безопасность гамма-интерферона при лечении внебольничной пневмонии: результаты открытого рандомизированного исследования IN/100000-317
Автор для корреспонденции: Бернс Светлана Александровна; e-mail: svberns@yandex.ru. Финансирование. Исследование проведено при спонсорской поддержке ООО «НПП Фармаклон». Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Аннотация Введение. Гамма-интерферон занимает важное место в патогенезе бактериальных инфекций. Показано, что некоторые микроорганизмы и антибактериальные агенты могут специфически репрессировать синтез эндогенного гамма-интерферона. Следовательно, дополнительное воздействие экзогенного гамма-интерферона может играть роль индуктора иммунной системы в условиях сниженного ответа на антибактериальную терапию. Цель исследования. Оценить эффективность и безопасность лекарственного препарата интерферона гамма в составе антибактериальной терапии у пациентов с внебольничной пневмонией. Материалы и методы исследования. Открытое рандомизированное контролируемое исследование в параллельных группах. Исследуемая группа пациентов получала в дополнение к базовой антибактериальной терапии гамма-интерферон, контрольная группа пациентов получала комбинированную антибактериальную терапию: цефтриаксон и азитромицин. Результаты исследования и обсуждение. Из 114 рандомизированных пациентов 110 полностью завершили исследование. Фактическое распределение пациентов выглядело следующим образом: 54 пациента – в исследуемой группе и 60 пациентов – в контрольной группе. Средняя длительность госпитализации в контрольной группе была достоверно более продолжительной почти на двое суток по сравнению с исследуемой. Аналогичная тенденция отмечена при анализе в субпопуляции бактериорезистентных пациентов, хотя по причине малой выборки пациентов не было достигнуто статистически значимых различий между группами. Анализ показателей изменения шкалы Борга относительно Визита скрининга показал статистически значимые отличия между группами в пользу исследуемой. К 8-10-му дням терапии снижение суммарного балла по шкале BCSS также достигало статистически значимых различий между группами в пользу исследуемой. В исследуемой группе также наблюдалась значимо большая динамика снижения уровня лейкоцитов. Остальные критерии оценки эффективности не показали статистической значимости различий между группами. По проявлению нежелательных реакций обе группы были сходны и статистически не различались. Выводы. Результаты исследования уверенно продемонстрировали клиническую эффективность и безопасность гамма-интерферона в составе антибактериальной терапии у пациентов с внебольничной пневмонией, в том числе у пациентов с бактериологически установленной резистентностью возбудителя заболевания. Применение гамма-интерферона сопровождалось достоверным сокращением периода болезни и длительности госпитализации. Ключевые слова гамма-интерферон, антибиотикотерапия, внебольничная пневмония, бактериальная устойчивость, цефтриаксон, азитромицин, уровень лейкоцитов doi: 10.29234/2308-9113-2019-7-4-110-125 Для цитирования: Белевский А. С., Бернс С. А., Ларцева О. А., Мясников А. Л., Надарая В. М., Талызин П. А. Эффективность и безопасность гамма-интерферона при лечении внебольничной пневмонии: результаты открытого рандомизированного исследования IN/100000-317. Медицина 2019; 7(4): 110-125 Введение Иммунный ответ организма является сложным многоэтапным биологическим процессом [8,24]. Раскрытие и понимание механизмов иммунологических реакций лежит в основе принципов антибактериальной терапии [5,6,9,11,13,19]. Анализ результатов исследований говорит о том, что гамма-интерферон занимает важное место в патогенезе бактериальных инфекций [17,18,21,26,27,29,33,35,38]. Показано, что некоторые микроорганизмы и антибактериальные средства могут специфически репрессировать синтез эндогенного гамма-интерферона [12,16,23,30,31]. Гипотеза исследования IN/100000-317 предполагала, что добавление гамма-интерферона к антибактериальной терапии повышает эффективность лечения пациентов с внебольничной пневмонией и снижает вероятность её неэффективности при наличии резистентности патогенного штамма возбудителя. Основной целью исследования была оценка эффективности и безопасности препарата Ингарон® в составе антибактериальной терапии у взрослых пациентов с внебольничной пневмонией, заболевших в период эпидемиологического подъёма заболеваемости острыми респираторными вирусными инфекциями. Материалы и методы исследования Открытое одноцентровое рандомизированное контролируемое в двух параллельных группах исследование проведено на базе ГБУЗ "ГКБ имени М.Е. Жадкевича ДЗМ" в период с 2017 года по 2019 год. С целью снизить риск возникновения систематических ошибок дизайн исследования подразумевал процедуру блочной рандомизации. Каждому пациенту после рандомизации выдавался дневник со шкалами BCSS для ежедневной самостоятельной оценки кашля и мокроты. Первоначальная оценка эффективности терапии проводилась по истечении двух суток от начала терапии. Ежедневно измерялись жизненно важные показатели, а также уровень сатурации крови. Забор мокроты для выполнения бактериологического исследования и анализа на чувствительность к антибиотикам выполнялся в течение первых трех дней с момента включения в исследование. При анализе данных были использованы стандартные критерии оценки бактериологической эффективности: эрадикация (элиминация); предполагаемая эрадикация; персистирование; эрадикация с колонизацией; суперинфекция; не определено. [22]. Положительным бактериологическим эффектом считали случаи эрадикации, в том числе предполагаемой, а также персистирования (при условии положительного клинического эффекта). Период наблюдения пациентов составил 30 дней. В исследование были включены пациенты с внебольничной пневмонией, госпитализированные в терапевтический стационар по клиническим показаниям, отвечающие следующим критериям включения/невключения (Таблица 1). Таблица 1. Критерии включения/невключения 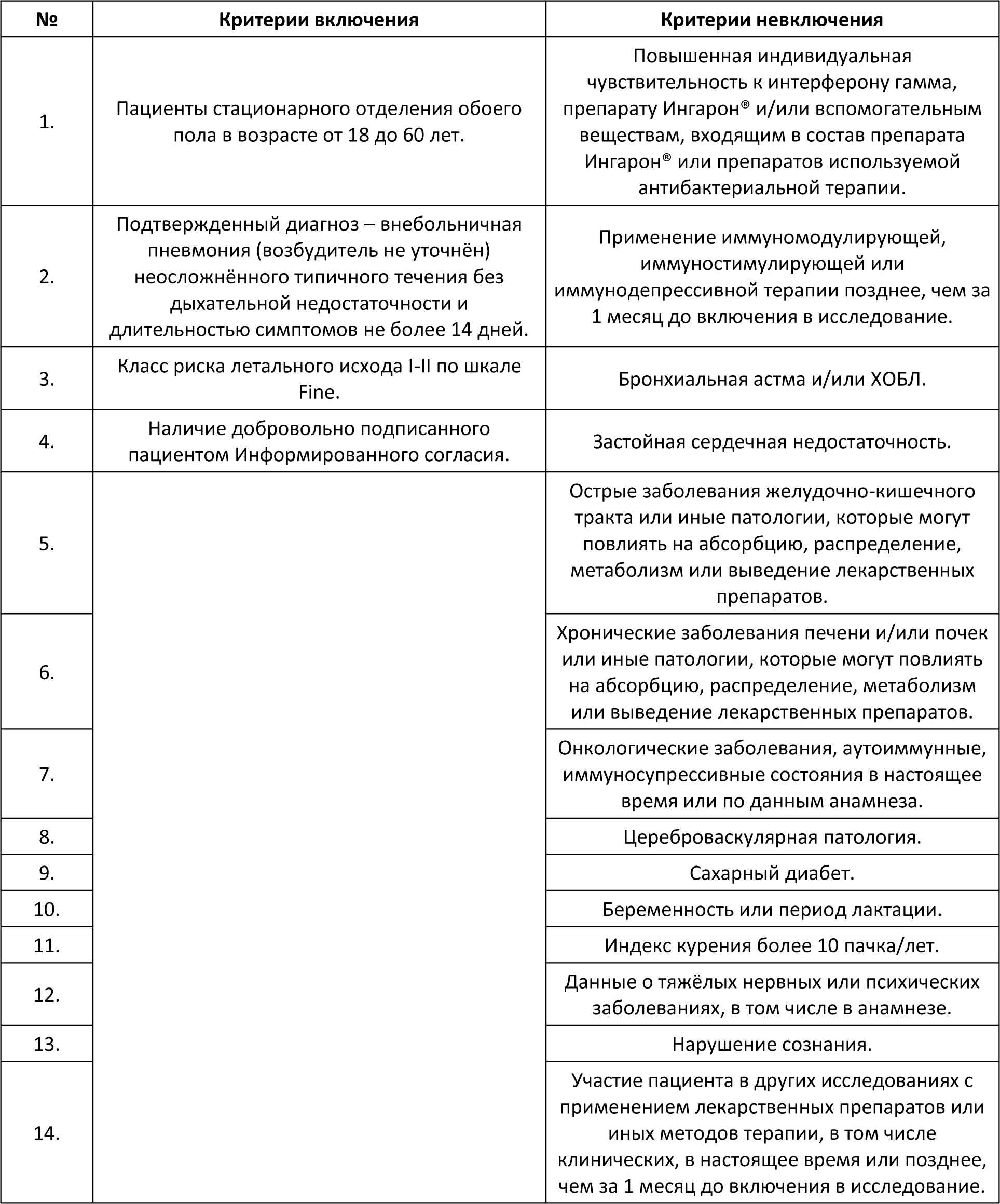 Препаратами базовой терапии были "Цефаксон" (1 г пор. фл. №1 производства Люпин Лтд.) и препарат "Азитромицин" (500 мг капс. уп. №3 производства ООО Производство медикаментов) [2,10,14,15,20,28,32,36]. Длительность базовой терапии устанавливалась индивидуально. Исследуемая группа пациентов получала в дополнение к стандартной антибиотикотерапии препарат Ингарон®, лиофилизат для приготовления раствора для внутримышечного и подкожного введения 100 000 МЕ (производства ООО "НПП Фармаклон"), содержащий в качестве активного компонента интерферон гамма человеческий рекомбинантный. Препарат назначался внутримышечно 100 000 МЕ один раз в сутки ежедневно в течение 5 дней. Оценка эффективности включала сравнительный анализ времени до клинической стабилизации состояния пациентов, изменений уровней лейкоцитов, сатурации кислорода крови, результатов оценки по шкалам Борга (Borg Scale) и BCSS, инфильтратов в лёгких по данным рентгенографии, посева мокроты. Дополнительно в рамках данного исследования был проведен сравнительный анализ длительности госпитализации пациентов двух групп. Клинической стабилизацией считалось состояние пациента, отвечающее следующим требованиям: ЧСС < 100 уд./мин, ЧД < 24 дых./мин, АД систолическое ≥ 90 мм рт.ст., уровень сатурации крови ≥ 90%. Время до клинической стабилизации оценивалось как день, в который происходила стабилизация пациента с начала госпитализации. Оценка безопасности проведена на основании жалоб пациента, данных физикального осмотра, оценки лабораторных и жизненно важных показателей, а также результатов ЭКГ [7]. Жалобы на симптомы интоксикации организма, такие как: головная боль, головокружение, слабость, повышение температуры тела и т.д., – которые характерны для течения основного заболевания, не регистрировались в качестве нежелательных явлений и учитывались при оценке общего состояния пациента для анализа эффективности терапии. Из 114 рандомизированных пациентов, 4 досрочно выбыли из исследования. Данные по досрочно выбывшим пациентам были исключены из анализируемой популяции. Расчет необходимого размера выборки был выполнен с помощью программы PASS 13.0. Исследование планировалось при мощности 80% и одностороннем уровне статистической значимости 0,05. При проведении статистического анализа были изучены данные по всем пациентам, завершившим исследование без значительных отклонений от Протокола. Для анализа данных были использованы стандартные методы, доступные в программе Stata 14 [37]. Для численных показателей демографических и антропометрических данных, жизненно важных показателей, а также численных параметров эффективности были вычислены: число непропущенных значений (N); минимальное значение (Min); максимальное значение (Max); арифметическое среднее (Mean); стандартное отклонение (SD); 95 % доверительный интервал (ДИ) для среднего; медиана (Me); межквартильный размах (IQR). Для качественных переменных было приведено абсолютное количество в формате n/N, а также доля (%). При анализе количественных данных было проведено предварительное тестирование переменных на нормальность распределения с помощью теста Шапиро-Уилка, а также теста на асимметрию и эксцесс с указанием значения p при тестировании нулевой гипотезы о нормальном распределении переменной. В случае нормального распределения внутригрупповое сравнение изменения параметров проводилось помощью парного t-теста. При значительном отклонении от нормальности (p<0,05) использован непараметрический тест Уилкоксона. Межгрупповое сравнение базовых количественных характеристик проведено с помощью t-теста (или теста Манна-Уитни) в зависимости от типа распределения данных. Для анализа динамики количественных показателей на различных визитах использовался тест Фридмана. В случае выявления статистически значимых различий последующие (post-hoc) попарные сравнения данных соответствующих визитов с данными на визите скрининга проводились с помощью критерия Уилкоксона. Для категориальных применен χ2-критерий или точный тест Фишера, если ожидаемая частота в какой-либо из ячеек была менее 5. Во всех тестах использован уровень значимости 0,05. Поправка на множественность сравнения не вводилась. Данное исследование проведено в соответствии с Протоколом исследования, стандартом специализированной медицинской помощи при пневмонии средней степени тяжести (2013), Хельсинкской Декларацией (ICH Harmonized Tripartite Guideline for GCP) и актуальными локальными регуляторными требованиями (ГОСТ Р 52379-2005 "Надлежащая клиническая практика", Приказ Минздрава РФ от 01.04.2016 №200н "Об утверждении правил надлежащей клинической практики"), а также согласно принципам Локального этического комитета, сопровождавшего данное исследование. Исследование было одобрено Локальным этическим комитетом ГБУЗ "ГКБ имени М.Е. Жадкевича ДЗМ". Результаты и обсуждение В исследовании приняли участие 114 пациентов мужского и женского пола в возрасте от 18 до 69 лет. Ниже приведена описательная статистика демографических и антропометрических характеристик пациентов (Таблица 2). Таблица 2. Демографическая и биометрическая характеристика пациентов  Межгрупповое сравнение количественных базовых характеристик не выявило статистически значимых отличий между группами (p > 0,05) по возрасту и ИМТ. Достоверная разница в массе тела не была принята во внимание. В исследуемую группу было рандомизировано 30 мужчин (55,6%) и 24 женщины (44,4%), тогда как в контрольной группе соотношение мужчин и женщин составило 41 (68,3%) и 19 (31,7%) соответственно. Межгрупповое сравнение распределения пациентов по полу не выявило статистически значимых отличий между группами (p = 0,160), так же, как и по статусу курения (p = 0,388; Таблица 3). Таблица 3. Распределение пациентов по статусу курения 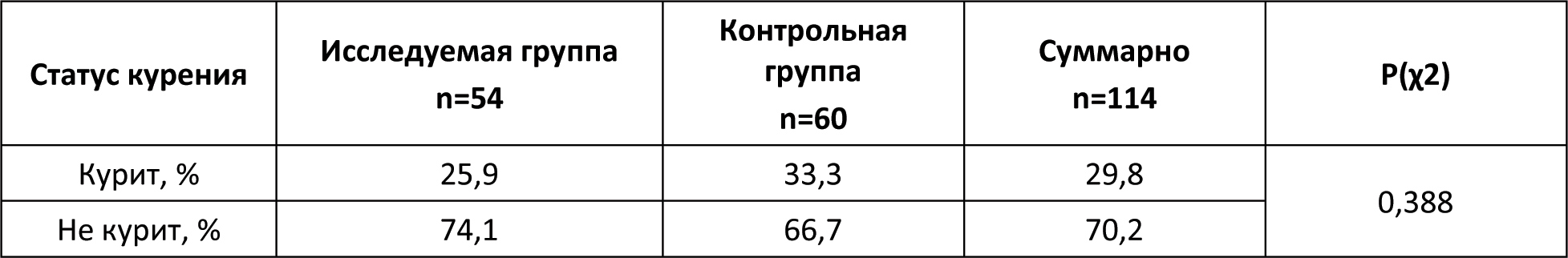 В обеих группах наиболее распространенным (43,9%) был диагноз правосторонней внебольничной пневмонии. Зарегистрированы редкие случаи верхнедолевой, среднедолевой, нижнедолевой полисегментарной и сегментарной пневмонии. У трех пациентов (5,7%) в исследуемой группе и у шести пациентов (10,2%) в контрольной группе было зафиксировано наличие осложнений основного заболевания. Также у двух пациентов в каждой из групп отмечалось наличие дыхательной недостаточности. Средние значения длительности возникновения симптомов составили 7,2 ± 5,4 дней – в исследуемой группе и 5,8 ± 4,1 дней в контрольной группе. Статистически значимых отличий по вышеуказанным характеристикам между группами не выявлено. Ниже представлены данные по результатам бактериального посева на визите скрининга (Таблица 4). Таблица 4. Данные по наличию бактериорезистентности на скрининге 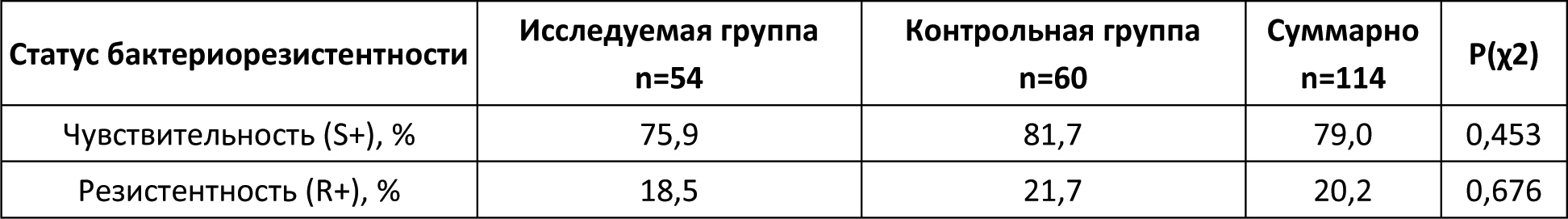 У 10 пациентов исследуемой группы и у 13 пациентов контрольной группы была выявлена резистентность бактерий к антибиотикам цефтриаксон и/или азитромицин. Данные пациенты были включены в подгруппу R+ (бактериорезистентные пациенты). Наиболее часто встречающими патогенами были бактерии рода Streptococcus1 Streptococcus mitis, salivarius, oralis, pneumonia, pyogenes, parasanguinis, sanguinis, anginosus Staphylococcus aureus, saprophyticus, haemolyticus Анализ данных по жизненно важным показателям, результатам физикального осмотра и сопутствующим заболеваниям, шкалам FINE и Borg, рентгенографии на Визите скрининга также показал отсутствие статистически значимых отличий между группами. Длительность участия каждого пациента в исследовании составила в среднем 30 дней. Оценка эффективности В контрольной группе все пациенты были стабилизированы к 7-м суткам в группе контроля и к 5-м суткам в группе исследования. Доля нестабильных пациентов в первые сутки терапии в исследуемой группе снижалась до значения менее 25%, что наблюдалось в контрольной группе только на следующий день. Аналогичная тенденция отмечена при анализе в субпопуляции бактериорезистентных пациентов. К 10-му дню терапии доля госпитализированных пациентов в исследуемой группе резко снижается приблизительно до 30%, в то время как в контрольной группе около половины больных по-прежнему остаются в стационаре. Выявлены статистически значимые различия между двумя группами (р=0.034) по данному параметру. Средняя длительность госпитализации в контрольной группе составила 11,5 дней, в исследуемой группе – 9,8 дней. Таким образом, при применении исследуемого препарата достигается сокращение госпитализации на 15%. Аналогичная тенденция отмечена при анализе в субпопуляции бактериорезистентных пациентов, хотя по причине малой выборки пациентов не было достигнуто статистически значимых различий между группами. Ниже в таблице 5 представлены результаты сравнительной оценки динамики изменения показателей эффективности в двух группах по окончании терапии относительно Визита скрининга. Таблица 5. Динамика изменений показателей эффективности в двух группах 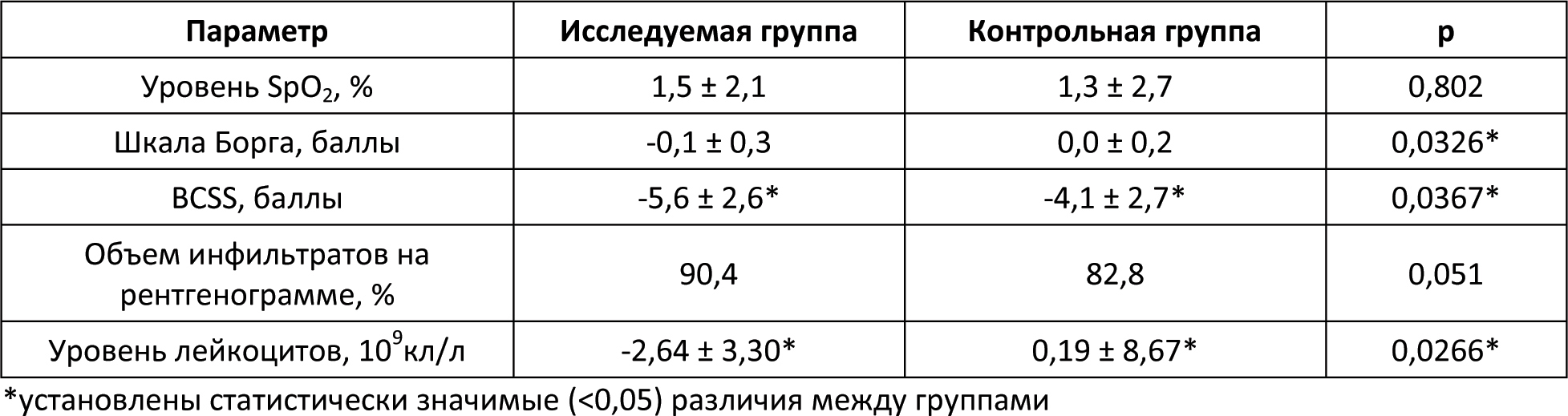 Анализ показателей изменения шкалы Борга на различных Визитах относительно Визита скрининга показал статистически значимое снижение в обеих группах, начиная с Визита 2. При этом к Визиту 4 наблюдались статистически значимые отличия между группами (p=0,0326) в пользу исследуемой группы, в которой отмечено более выраженное падение по данному показателю. На Визите 5 все пациенты в обеих группах отмечали отсутствие жалоб на одышку. Аналогично был проведен анализ динамики показателей шкалы BCSS. Была отмечена тенденция к более быстрому снижению показателей в исследуемой группе. К завершению периода наблюдения (8-10-му дню терапии – Визит 4) снижение суммарного балла достигало статистически значимых различий между группами (р=0,0367). Так, среднее снижение баллов в контрольной группе составило -4,1 ± 2,7, а в исследуемой группе – -5,6 ± 2,6, что было статистически значимым. По результатам оценки объема инфильтратов в легких по данным рентгенограммы в двух исследуемых группах пациентов не отмечено достоверных изменений между группами (p=0,051). Для большей части пациентов в обеих группах отмечалась положительная динамика инфильтративного затемнения на Визите 4 с некоторым перевесом в пользу исследуемой группы, в которой положительная динамика отмечена для 90,4% пациентов (vs. 82,8% в контрольной группе). Наблюдалась значимо большая (p=0,0266) динамика снижения уровня лейкоцитов к Визиту 4 относительно визита скрининга в исследуемой группе по сравнению с контрольной группой3 Относительное снижение зарегистрировано в рамках референсных норм локальной контрольно-диагностической лаборатории. Полная эрадикация (элиминация), в том числе предполагаемая, была несколько чаще достигнута в исследуемой группе по сравнению с контрольной группой. Персистирование наблюдалось в 2 раза чаще в исследуемой группе, при этом чаще всего отмечалась стабилизация роста бактерий или снижение титра микроорганизмов (частичная эрадикация); в контрольной группе в большинстве случаев персистирования наблюдался рост количества выделенных бактерий. Эрадикация с колонизацией встречалась в 4 раза чаще в контрольной группе (Таблица 6). Таблица 6. Динамика эрадикации бактерий в обеих группах 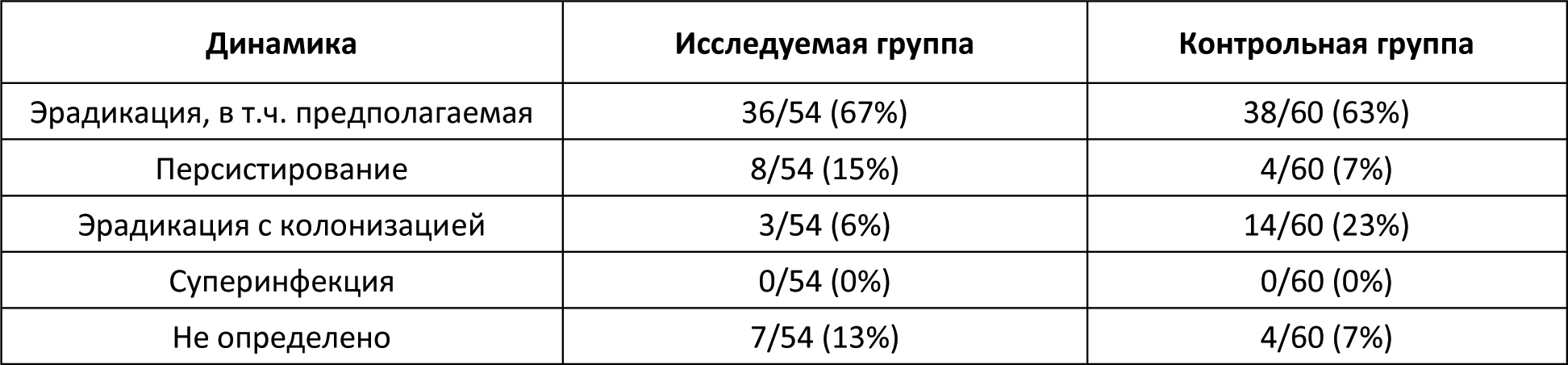 Оценка безопасности По проявлению нежелательных реакций обе группы были сходны и статистически не различались (р=0,590). Серьезных нежелательных явлений в ходе исследования не зарегистрировано. Обсуждение результатов Анализ на сопоставимость двух групп выявил достоверную разницу по массе тела (р=0,0462). При этом статистически значимых отличий между группами (p>0,05) по интегральному параметру "индекс массы тела" найдено не было, поэтому данный фактор не был принят во внимание. Для большинства пациентов стабилизация состояния наблюдалась уже в первые сутки госпитализации, либо они исходно поступали в клинически стабильном состоянии. Тем не менее, в группе контроля отмечен более длительный период стабилизации пациентов по сравнению с исследуемой группой (на 2 дня). Межгрупповое сравнение данных по уровням сатурации крови также не выявило статистически значимых отличий ни в одной из анализируемых временных точек (с 1-го по 12-й день терапии). По всей видимости, это также связано с тем, что для большинства пациентов показатели уровня сатурации крови находились в пределах нормальных значений уже на момент начала терапии, то есть пациенты были исходно клинически стабильны, и пневмония не сопровождалась дыхательной недостаточностью. Среди прочих показателей эффективности терапии отмечено статистически значимое (p<0,05) снижение уровня лейкоцитов к концу курса стационарного лечения для пациентов исследуемой группы в сравнении с контрольной группой. При этом клинически значимых изменений показателей общего анализа крови и других смещений лейкоцитарной формулы не установлено. Возможно, данное явление связано с относительным снижением количества эозинофилов. Известно, что любой инфекционный процесс сопровождается дисбалансом продукции цитокинов [4,5,35]. Поскольку цитокины, отвечающие за клеточно-опосредованный иммунный ответ – такие как интерферон гамма – способны смещать равновесие со стороны гуморального иммунитета, активируя Т-лимфоциты 1-го типа (Th1), они могут вызывать деактивацию лейкоцитов, в частности, эозинофилов, и приводить к снижению уровня данных клеток в крови [1,24,25]. В исследованиях показана обратная корреляционная зависимость между уровнями гамма-интерферона и эозинофилов [19,34]. Также есть сведения о том, что эозинофилия и лейкоцитоз ассоциированы с повреждением тканей и более тяжелым протеканием инфекционных заболеваний [1,3]. В настоящем исследовании относительное снижение уровня лейкоцитов в исследуемой группе в сравнении с контрольной сопровождалось более эффективным лечением пациентов и сокращением сроков госпитализации, что подтверждает имеющиеся в литературе данные. Выводы Результаты настоящего открытого рандомизированного контролируемого исследования показали клиническую эффективность гамма-интерферона в составе антибактериальной терапии при лечении внебольничной пневмонии, в том числе вызванной резистентными штаммами. Применение препарата Ингарон® в комплексной терапии внебольничной пневмонии сопровождается достоверным сокращением периода болезни и госпитализации. Отмечена высокая безопасность терапии препаратом Ингарон®, что позволяет рекомендовать его для широкого применения в клинической практике. Список литературы 1. Ахнаев Э.Х., Чучалин А.Г. Легочные эозинофилии: диагностика, подходы к терапии. Пульмонология 2012; (4): 106-15. 2. Денисов И.Н. и др. Внебольничная пневмония: руководство для врачей общей практики (семейных врачей). 2014. 3. Енисеева Е.С., Орлова Г.М., Сараева Н.О., Смолькова Л.Г. Ассоциированные с эозинофилией заболевания и расстройства. Сибирский медицинский журнал 2006; (6): 14-20. 4. Колобовникова Ю.В., Уразова О.И., Новицкий В.В., Воронкова О.В., Михеева К.О. и др. Показатели клеточного и гуморального иммунного ответа при туберкулезе легких, сопровождающемся эозинофилией. Бюллетень сибирской медицины 2012; (1): 39-45. 5. Медицинская микробиология, вирусология и иммунология. том 1. Под ред. В.В. Зверева, М.Н. Бойченко. М.: ГЭОТАР-Медиа, 2010. 6. Мешкова Р.Я. Руководство по иммунопрофилактике для врачей. Смоленская государственная медицинская академия, 1998. 7. Национальный стандарт РФ. Оценка клинических данных по безопасности: терминология и стандарты экспресс-отчетности. 2009. 8. Орлов Р.С., Ноздрачев А.Д. Нормальная физиология: учебник. 2-е изд., исправл. и доп. М.: ГЭОТАР-Медиа, 2010. 9. Пашков Е., Караулов А., Быков С., Корн М., Быков А. и др. Атлас по медицинской микробиологии, вирусологии и иммунологии. М.: Медицинское информационное агентство, 2008. 10. Практическое руководство по антиинфекционной химиотерапии. Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. М.: НИИАХ СГМА, 2002. 11. Прозоркина Н.В., Рубашкина Л.А. Основы микробиологии, вирусологии и иммунологии: учебное пособие для средних специальных медицинских учебных заведений. Ростов-на-Дону: Феникс, 2002. 12. Ризопулу А.П., Гариб Ф.Ю. Взаимодействия патогенных бактерий с врожденными иммунными реакциями хозяина. Инфекция и иммунитет 2012; 2(3): 581-96. 13. Соловьева А.С. Антибактериальный иммунитет. Бюллетень физиологии и патологии дыхания 2015; (58): 115-20. 14. Чучалин А.Г., Синопальников А.И., Козлов Р.С., Тюрин И.Е., Рачина С.А. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. М.: 2014. 15. Чучалин А.Г., Синопальников А.И., Страчунский Л.С. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. Клиническая микробиология и aнтимикробная xимиотерапия 2006; 8(1): 54-86. 16. Brooks B.M., Hart C.A., Coleman J.W. Differential effects of beta-lactams on human IFN-gamma activity. J Antimicrob Chemother 2005; 56: 1122-5. 17. Dalton D.K., Pitts-Meek S., Keshav S., Figari I.S., Bradley A. et al. Multiple defects of immune cell function in mice with disrupted interferon-gamma genes. Science 1993; 259: 1739-42. 18. Eddens T., Kolls J.K. Host defenses against bacterial lower respiratory tract infection Curr Opin Immunol 2012; 24(4): 424-30. 19. Fortes A., Pereira K., Antas P.R.Z., Franken C.L.M.C., Dalcolmo M. et al. Detection of in vitro interferon-γ and serum tumour necrosis factor-α in multidrug-resistant tuberculosis patients. Clin Exp Immunol 2005; 141(3): 541-8. 20. Garcia Vazquez E., Mensa J., Mertinez J.A. et al. Lower mortality among patients with community–acquired pneumonia treated with a macrolide plus a beta–lactam agent versus a beta-lactam alone. Eur J Clin Microbiol Infect Dis 2005; 24: 190-5. 21. Gattoni A., Parlato A., Vangieri B., Bresciani M., Derna R. Interferon-gamma: biologic functions and HCV therapy (type I/II) (1 of 2 parts) Clin Ter 2006; 157: 377-86. 22. Gilbert D.N., Beam T.R., Kunin C.M. The implications for Europe of revised FDA guidelines for clinical trials with anti-infective agents. EurJ Clin Microbiol Infect Dis 1990; 9 (7): 552-8. 23. Harding C.V., Boom W.H. Regulation of antigen presentation by Mycobacterium tuberculosis: a role for Toll-like receptors. Nat Rev Microbiol 2010; 8: 296-307. 24. Janeway C.A. Jr., Travers P., Walport M. et al. Immunobiology: The Immune System in Health and Disease. 5th edition. New York: Garland Science, 2001. 25. John B., Rajagopal D., Pashine A., Rath S., George A. et al. Role of IL-12-independent and IL-12-dependent pathways in regulating generation of the IFNgamma component of T cell responses to Salmonella typhimurium. J. Immunol 2002; 169: 2545-52. 26. Koh W.J., Kwon O.J., Suh G.Y., Chung M.P., Kim H. et al. Six-month therapy with aerosolized interferon-gamma for refractory multidrug-resistant pulmonary tuberculosis. J Korean Med Sci 2004; 19(2): 167-71. 27. Milanés-Virelles M.T., García-García I., Santos-Herrera Y., Valdés-Quintana M., Valenzuela-Silva C.M. et al. MACGAM Study Group. Adjuvant interferon gamma in patients with pulmonary atypical Mycobacteriosis: a randomized, double-blind, placebo-controlled study. BMC Infect Dis 2008; 8: 17. doi: 10.1186/1471-2334-8-17. 28. Nie W., Li B., Xiu Q. β-Lactam/macrolide dual therapy versus β-lactam monotherapy for the treatment of community-acquired pneumonia in adults: a systematic review and meta-analysis. J Anti-microb Chemother 2014; 69(6): 1441-6. 29. Onyeji C.O., Bui K.Q., Nicolau D.P., Nightingale C.H., Bow L. et al. Influence of adjunctive interferon-gamma on treatment of gentamicin- and vancomycin-resistant Enterococcus faecalis infection in mice. Int J Antimicrob Agents 1999; 12(4): 301-9. 30. Parnham M.J. Immunomodulatory effects of antimicrobials in the therapy of respiratory tract infections. Curr Opin Infect Dis 2005; 18: 125-31. 31. Pinheiro R.O., Oliveira E.B., Santos G., Sperandio da Silva G.M., Andrade Silva B.J. et al. Different immunosuppressive mechanisms in multi-drug-resistant tuberculosis and non-tuberculous mycobacteria patients. Clin Exp Immunol 2013; 171(2): 210-9. 32. Pneumonia in adults: diagnosis and management. Clinical guideline [CG191], 2014. 33. Razaghi A., Owens L., Heimann K. Review of the recombinant human interferon gamma as an immunotherapeutic: Impacts of production platforms and glycosylation. J Biotech 2016; 240: 48-60. 34. Rubins J.B., Pomeroy С. Role of gamma interferon in the pathogenesis of bacteremic pneumococcal pneumonia. Infect. Immun 1997; 65(7): 2975-7. 35. Shtrichman R., Samuel C.E. The role of gamma interferon in antimicrobial immunity. Current Opinion in Microbiology 2001; 4: 251-9. 36. Skalsky K., Yahav D., Lador A., Eliakim-Raz N., Leibovici L. et al. Macrolides vs. quinolones for community-acquired pneumonia: meta-analysis of randomized controlled trials. Clin Microbiol Infect 2013; 19(4): 370-8. doi: 10.1111/j.1469-0691.2012.03838.x. 37. Stata Statistical Software: Release 14. College Station T: SL, 2. 38. Steimle V., Siegrist C.A., Mottet A., Lisowska-Grospierre B., Mach B. Regulation of MHC class II expression by interferon-gamma mediated by the transactivator gene CIITA. Science 1994; 265(5168): 106-9.
Corresponding author: Svetlana Berns; e-mail: svberns@yandex.ru. Conflict of interest. The authors declare no conflict of interest. Funding. The study was sponsored by Pharmaclon LLC. Abstract Introduction. Gamma-interferon plays an important role in the pathogenesis of bacterial infections. It was shown that some microorganisms, as well as the use of antibiotics, can specifically repress the synthesis of endogenous gamma-interferon. Therefore, the additional effect of exogenous gamma-interferon can play the role of the immune system inducer in a reduced response to antibiotic therapy conditions. Objective. To evaluate the efficacy and safety of gamma-interferon as part of antibiotic therapy in patients with community-acquired pneumonia. Materials and methods of research. Open randomized controlled trial in parallel groups. The studied group of patients received, in addition to the basic antibacterial therapy, gamma-interferon; the control group of patients received the combined antibacterial therapy: ceftriaxone and azithromycin. Study Results and Discussion. Of the 114 randomized patients, 110 completed the study. The actual distribution of patients was as follows: 54 patients in the study group and 60 patients in the control group. The average duration of hospital stay in the control group was significantly longer – by almost two days compared with the study group. The similar trend was observed in the subpopulation of bacteria resistant patients, although due to the small sample of patients no statistically significant differences between the groups were demonstrated. Changes in the Borg scale compared to the screening visit showed statistically significant differences between the groups in favor of the study group. By the 8-10th days of therapy, a decrease in the total score on the BCSS scale also reached statistically significant differences between the groups in favor of the study group. In the study group a significantly greater dynamics of a decrease in the level of leukocytes was also observed. The remaining criteria of effectiveness did not show statistically significant differences between groups. In terms of adverse reactions, both groups were similar and did not differ statistically. Conclusions: The results of the study positively demonstrated clinical efficacy and safety of gamma-interferon as part of antibiotic therapy in patients with community-acquired pneumonia, including patients with bacteriologically confirmed pathogen resistance. The use of gamma-interferon was accompanied by a significant reduction in the length of sickness and the duration of hospital stay. Key words gamma-interferon, antibiotic therapy, community-acquired pneumonia, bacterial resistance, ceftriaxone, azithromycin, white blood cell count References 1. Ahnaev Je.H., Chuchalin A.G. Legochnye eozinofilii: diagnostika, podhody k terapii [Pulmonary eosinophilia: diagnosis, treatment approaches]. Pul'monologija [Pulmonology] 2012; (4): 106-15. (In Russ.) 2. Denisov I.N. et al. Vnebol'nichnaya pnevmoniya: rukovodstvo dlya vrachej obshchej praktiki (semejnyh vrachej) [Community-acquired pneumonia: a guide for general practitioners (family doctors)]. 2014. (In Russ.) 3. Eniseeva E.S., Orlova G.M., Saraeva N.O., Smol'kova L.G. Associirovannye s eozinofiliej zabolevaniya i rasstrojstva [Diseases and disorders associated with eosinophilia]. Sibirskij medicinskij zhurnal [Siberian medical journal] 2006; (6): 14-20. (In Russ.) 4. Kolobovnikova Ju.V., Urazova O.I., Novickij V.V., Voronkova O.V., Miheeva K.O. et al. Pokazateli kletochnogo i gumoral'nogo immunnogo otveta pri tuberkuleze legkih, soprovozhdayushchemsya eozinofiliej [Indicators of cellular and humoral immune response in pulmonary tuberculosis accompanied by eosinophilia]. Bjulleten' sibirskoj mediciny [Siberian medicine bulletin] 2012; (1): 39-45. (In Russ.) 5. Medicinskaya mikrobiologiya, virusologiya i immunologiya. tom 1 [Medical microbiology, virology and immunology. Vol. 1.]. V.V. Zverev, M.N. Bojchenko (editors). Moscow: GEOTAR-Media, 2010. (In Russ.) 6. Meshkova R.Ya. Rukovodstvo po immunoprofilaktike dlya vrachej [Immunization Guide for Doctors]. Smolenskaja gosudarstvennaja medicinskaja akademija [Smolensk State Medical Academy], 1998. (In Russ.) 7. Nacional'nyj standart RF. Ocenka klinicheskih dannyh po bezopasnosti: terminologiya i standarty ekspress-otchetnosti [National Standard of the Russian Federation. Clinical Safety Data Assessment: Terminology and Express Reporting Standards]. 2009. (In Russ.) 8. Orlov R.S., Nozdrachev A.D. Normal'naya fiziologiya: uchebnik. 2-e izd., ispravl. i dop [Normal physiology: tutorial. 2-nd edition, corrected and supplemented]. Moscow: GEOTAR-Media, 2010. (In Russ.) 9. Pashkov E., Karaulov A., Bykov S., Korn M., Bykov A. et al. Atlas po medicinskoj mikrobiologii, virusologii i immunologii [Atlas of Medical Microbiology, Virology and Immunology]. Moscow: Medicinskoe informacionnoe agentstvo, 2008. (In Russ.) 10. Prakticheskoe rukovodstvo po antiinfekcionnoj himioterapii [Practical Guide to Anti-Infectious Chemotherapy]. L.S. Strachunsky, Ju.B. Belousov, S.N. Kozlov (editors). Moscow: NIIAH SGMA, 2002. (In Russ.) 11. Prozorkina N.V., Rubashkina L.A. Osnovy mikrobiologii, virusologii i immunologii: uchebnoe posobie dlja srednih special'nyh medicinskih uchebnyh zavedenij [Fundamentals of Microbiology, Virology and Immunology: study guide for secondary specialized medical educational institutions]. Rostov-na-Dony: Feniks, 2002. (In Russ.) 12. Rizopulu A.P., Garib F.Ju. Vzaimodejstviya patogennyh bakterij s vrozhdennymi immunnymi reakciyami hozyaina [Interactions of pathogenic bacteria with innate host immune responses]. Infekcija i immunitet [Infection and immunity] 2012; 2(3): 581-96. (In Russ.) 13. Solov'eva A.S. Antibakterial'nyj immunitet [Antibacterial immunity]. Bjulleten' fiziologii i patologii dyhanija [Bulletin of Respiratory Physiology and Pathology] 2015; (58): 115-20. (In Russ.) 14. Chuchalin A.G., Sinopal'nikov A.I., Kozlov R.S., Tjurin I.E., Rachina S.A. Vnebol'nichnaya pnevmoniya u vzroslyh: prakticheskie rekomendacii po diagnostike, lecheniju i profilaktike [Community-acquired pneumonia in adults: practical recommendations for diagnosis, treatment and prevention]. Moscow: 2014. (In Russ.) 15. Chuchalin A.G., Sinopal'nikov A.I., Strachunskij L.S. et al. Vnebol'nichnaya pnevmoniya u vzroslyh: prakticheskie rekomendacii po diagnostike, lecheniyu i profilaktike [Community-acquired pneumonia in adults: practical recommendations for diagnosis, treatment and prevention]. Klinicheskaja mikrobiologiya i antimikrobnaja himioterapija [Clinical microbiology and antimicrobial chemotherapy] 2006; 8(1): 54-86. (In Russ.) 16. Brooks B.M., Hart C.A., Coleman J.W. Differential effects of beta-lactams on human IFN-gamma activity. J Antimicrob Chemother 2005; 56: 1122-5. 17. Dalton D.K., Pitts-Meek S., Keshav S., Figari I.S., Bradley A. et al. Multiple defects of immune cell function in mice with disrupted interferon-gamma genes. Science 1993; 259: 1739-42. 18. Eddens T., Kolls J.K. Host defenses against bacterial lower respiratory tract infection Curr Opin Immunol 2012; 24(4): 424-30. 19. Fortes A., Pereira K., Antas P.R.Z., Franken C.L.M.C., Dalcolmo M. et al. Detection of in vitro interferon-γ and serum tumour necrosis factor-α in multidrug-resistant tuberculosis patients. Clin Exp Immunol 2005; 141(3): 541-8. 20. Garcia Vazquez E., Mensa J., Mertinez J.A. et al. Lower mortality among patients with community–acquired pneumonia treated with a macrolide plus a beta–lactam agent versus a beta-lactam alone. Eur J Clin Microbiol Infect Dis 2005; 24: 190-5. 21. Gattoni A., Parlato A., Vangieri B., Bresciani M., Derna R. Interferon-gamma: biologic functions and HCV therapy (type I/II) (1 of 2 parts) Clin Ter 2006; 157: 377-86. 22. Gilbert D.N., Beam T.R., Kunin C.M. The implications for Europe of revised FDA guidelines for clinical trials with anti-infective agents. Eur J Clin Microbiol Infect Dis 1990; 9(7): 552-8. 23. Harding C.V., Boom W.H. Regulation of antigen presentation by Mycobacterium tuberculosis: a role for Toll-like receptors. Nat Rev Microbiol 2010; 8: 296-307. 24. Janeway C.A.Jr., Travers P., Walport M. et al. Immunobiology: The Immune System in Health and Disease. 5th edition. New York: Garland Science, 2001. 25. John B., Rajagopal D., Pashine A., Rath S., George A. et al. Role of IL-12-independent and IL-12-dependent pathways in regulating generation of the IFN-gamma component of T cell responses to Salmonella typhimurium. J. Immunol 2002; 169: 2545-52. 26. Koh W.J., Kwon O.J., Suh G.Y., Chung M.P., Kim H. et al. Six-month therapy with aerosolized interferon-gamma for refractory multidrug-resistant pulmonary tuberculosis. J Korean Med Sci 2004; 19(2): 167-71. 27. Milanés-Virelles M.T., García-García I., Santos-Herrera Y., Valdés-Quintana M., Valenzuela-Silva C.M. et al. MACGAM Study Group. Adjuvant interferon gamma in patients with pulmonary atypical Mycobacteriosis: a randomized, double-blind, placebo-controlled study. BMC Infect Dis 2008; 8: 17. doi: 10.1186/1471-2334-8-17. 28. Nie W., Li B., Xiu Q. β-Lactam/macrolide dual therapy versus β-lactam monotherapy for the treatment of community-acquired pneumonia in adults: a systematic review and meta-analysis. J Anti-microb Chemother 2014; 69(6): 1441-6. 29. Onyeji C.O., Bui K.Q., Nicolau D.P., Nightingale C.H., Bow L. et al. Influence of adjunctive interferon-gamma on treatment of gentamicin- and vancomycin-resistant Enterococcus faecalis infection in mice. Int J Antimicrob Agents 1999; 12(4): 301-9. 30. Parnham M.J. Immunomodulatory effects of antimicrobials in the therapy of respiratory tract infections. Curr Opin Infect Dis 2005; 18: 125-31. 31. Pinheiro R.O., Oliveira E.B., Santos G., Sperandio da Silva G.M., Andrade Silva B.J. et al. Different immunosuppressive mechanisms in multi-drug-resistant tuberculosis and non-tuberculous mycobacteria patients. Clin Exp Immunol 2013; 171(2): 210-9. 32. Pneumonia in adults: diagnosis and management. Clinical guideline [CG191], 2014. 33. Razaghi A., Owens L., Heimann K. Review of the recombinant human interferon gamma as an immunotherapeutic: Impacts of production platforms and glycosylation. J Biotech 2016; 240: 48-60. 34. Rubins J.B., Pomeroy С. Role of gamma interferon in the pathogenesis of bacteremic pneumococcal pneumonia. Infect. Immun 1997; 65(7): 2975-7. 35. Shtrichman R., Samuel C.E. The role of gamma interferon in antimicrobial immunity. Current Opinion in Microbiology 2001; 4: 251-9. 36. Skalsky K., Yahav D., Lador A., Eliakim-Raz N., Leibovici L. et al. Macrolides vs. quinolones for community-acquired pneumonia: meta-analysis of randomized controlled trials. Clin Microbiol Infect 2013; 19(4): 370-8. doi: 10.1111/j.1469-0691.2012.03838.x. 37. Stata Statistical Software: Release 14. College Station T: SL, 2. 38. Steimle V., Siegrist C.A., Mottet A., Lisowska-Grospierre B., Mach B. Regulation of MHC class II expression by interferon-gamma mediated by the transactivator gene CIITA. Science 1994; 265(5168): 106-9. |
[ См. также ] Рубрики |
|||||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|