| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Изменения морфологии S. aureus в условиях их культивирования в присутствии антибактериальных препаратов
Автор для корреспонденции: Шевлягина Наталья Владимировна; e-mail: microbanatomy@gmail.com. Финансирование. Исследование не имело спонсорской поддержки. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Аннотация Актуальным остается поиск новых, в том числе микроскопических, методов выявления и идентификации возбудителя в биологическом материале. Изучение изменений ультраструктуры микроорганизмов в результате воздействия различных групп антибиотиков представляется немаловажным, так как морфология бактериальной клетки значительно меняется в зависимости от условий культивирования. Цель исследования: 1. Выявить характер изменений ультраструктуры сохранившихся бактериальных клеток S. aureus, культивированных в присутствии антибиотиков. 2. Определить жизнеспособность той части популяции S. aureus, которая сохранилась в условиях воздействия подавляющих концентраций антибактериальных препаратов. 3. Определить, являются ли ультраструктурные изменения референсного штамма S. aureus АТСС 25923 в предлагаемых условиях полностью отражающими характер этих изменений для штаммов, выделенных из клинического материала. Материалы и методы. Для исследования ультраструктуры S. aureus были использованы три штамма S. aureus, выделенных из биологического материала и референсный штамм S. aureus АТСС 25923. Использованные штаммы S. aureus культивировали в присутствии антибактериальных препаратов разных фармакологических групп в условиях проведения теста определения антибиотикочувствительности диско-диффузионным методом. Анализ был проведен на основании данных, полученных с помощью сканирующей электронной микроскопии (СЭМ). В процессе пробоподготовки для СЭМ была применена техника отпечатка бактерий с агаризованной питательной среды. Результаты и выводы. Наиболее общим признаком для штаммов клинических изолятов S. aureus явилось формирование большого количества бактериальных клеток специфической дисковидной формы в зонах воздействия антибиотиков бактериостатического механизма действия. В условиях применения бактерицидных препаратов часть популяции сохраняла сферическую форму, другая часть имела неправильные очертания. Изменения размеров бактериальных клеток в зонах подавления роста имели разнонаправленный характер. Культивирование бактерий в условиях воздействия подавляющих концентраций антибактериальных препаратов стимулировало выработку экзоклеточного матрикса. Ультраструктурные признаки фенотипической изменчивости референсного штамма S. aureus АТСС 25923 не полностью соответствовали изменениям морфологии бактериальных клеток штаммов клинических изолятов. Жизнеспособность сохранившихся в зонах подавления роста бактерий была подтверждена во всех случаях воздействия антибиотиков, кроме гентамицина. Таким образом, проведенное исследование выявило характер изменений ультраструктуры S. aureus как проявлений фенотипической изменчивости микроорганизмов в ответ на присутствие различных по механизму действия антибактериальных препаратов. Ключевые слова ультраструктура S. aureus, антибактериальные препараты, сканирующая электронная микроскопия, фенотипическая изменчивость S. aureus, биопленка doi: 10.29234/2308-9113-2020-8-2-31-49 Для цитирования: Андреевская С. Г., Шевлягина Н. В., Псеунова Д. Р. Изменения морфологии S. aureus в условиях их культивирования в присутствии антибактериальных препаратов. Медицина 2020; 8(2): 31-49. Наиболее частой причиной неэффективности антибиотикотерапии является резистентность микроорганизмов к различным группам антибактериальных препаратов. Этиотропная терапия, назначенная в лечебном учреждении как эмпирически, так и на основании результатов определения чувствительности к антибиотикам выделенного штамма, в части случаев не дает ожидаемой быстрой положительной динамики состояния пациента. Это приводит к замене препарата или удлинению курса лечения. Не исключено, что наличие длительных остаточных явлений, рецидивов, и развитие хронического инфекционного процесса в определенной степени являются последствиями неэффективности противомикробной терапии в дебюте заболевания [5,18,24]. Механизмы развития резистентности микроорганизмов к антибиотикам на биохимическом и генетическом уровнях являются предметом, активно изучаемым в последние десятилетия [4,5,15,19,20,23]. Наряду с этим, определенные трудности по-прежнему представляет выделение бактериальной культуры из биологического материала, особенно из крови пациентов при подозрении на бактериемию. Следовательно, не теряет актуальности поиск новых, в том числе и микроскопических, методов выявления и идентификации возбудителя. Изучение изменений ультраструктуры микроорганизмов, возникающих в результате воздействия на них различных групп антибиотиков, представляется в этой связи немаловажным, так как морфология бактериальной клетки значительно меняется в зависимости от условий культивирования. Большое количество работ было посвящено изменению ультраструктуры различных микроорганизмов, как в эксперименте, так и в биологическом материале, полученном от пациентов. Большинство из них основывались на данных трансмиссионной электронной микроскопии, что позволило выявить изменения ультраструктуры клеточной стенки и внутренних элементов бактериальной клетки [7,10,22,23,25]. S. aureus – грамположительная бактерия, являющаяся этиологическим фактором широкого спектра воспалительных процессов, от локальных до генерализованных. В значительной части случаев эффективность терапии этих заболеваний представляет непростую задачу в связи с множественной устойчивостью штаммов этого микроорганизма к антибактериальным препаратам [18,24]. В настоящее время для определения чувствительности микроорганизмов к антибиотикам общепринятыми являются диффузионные методы и методы последовательных серийных разведений. В нашем исследовании научный интерес был представлен изучением спектра морфологических изменений S. аureus, возникающих в условиях их культивирования в присутствии антибактериальных препаратов, с использованием диско-диффузионного метода определения чувствительности к антибиотикам в качестве экспериментальной модели. Особенность настоящего исследования заключается в применении сканирующей электронной микроскопии для анализа ультраструктуры микроорганизмов, культивировавшихся и сохранившихся в зонах воздействия подавляющих доз антибиотиков на агаризованной питательной среде. Более того, сканирующая электронная микроскопия была проведена без механического воздействия на колонии и предварительного обезвоживания. Предложенный способ подготовки препаратов и единые условия культивирования золотистого стафилококка в присутствии антибактериальных препаратов послужили основой для получения сравнимых результатов. Цель исследования 1. Выявить характер изменений ультраструктуры сохранившихся бактериальных клеток S. aureus, культивированных в присутствии антибиотиков. 2. Определить жизнеспособность той части популяции S. aureus, которая сохранилась в условиях воздействия подавляющих доз антибактериальных препаратов. 3. Определить, являются ли ультраструктурные изменения референсного штамма S. aureus АТСС 25923 в предлагаемых условиях полностью отражающими характер этих изменений для штаммов, выделенных из клинического материала. Материалы и методы Для исследования ультраструктуры S. aureus были использованы три клинических изолята, полученные из кала взрослых пациентов в количестве 1х106 КОЕ/мл при микробиологическом анализе микрофлоры кишечника, и референсный штамм S. aureus АТСС 25923 (из музейной коллекции лаборатории индикации и ультраструктурного анализа НИЦЭМ им. Н.Ф. Гамалеи). Видовое типирование штаммов клинических изолятов S. aureus было подтверждено с помощью метода матрично-активируемой лазерной десорбции-ионизации (МАЛДИ) и масс-спектрометрического анализатора MALDI-TOF (Bruker, Германия) (показатель score value соответствовал достоверной идентификации до вида и был равен 2,36) [1]. Тест на чувствительность к антибиотикам выделенных клинических изолятов S. aureus был проведен с помощью широко и успешно применяемого в клинической практике диско-диффузионного метода в соответствии с Клиническими рекомендациями определения чувствительности микроорганизмов к антимикробным препаратам (версия 2015-02) и методическими указаниями [2,3]. В работе были использованы антибактериальные препараты, относящиеся к разным фармакологическим группам: бензилпенициллин, гентамицин, эритромицин, офлоксацин, клиндамицин, цефокситин, линезолид. Стандартизированные диски с антибактериальным препаратами (Himedia Laboratories Pvt, Индия) содержали определенное количество антибиотика [2], при диффузии которого в агаризованную питательную среду в ней создавалась подавляющая концентрация, влияющая на рост посеянных на агар бактерий. Определение диаметра зон подавления роста (ЗПР) и интерпретация чувствительности S. aureus к антибиотикам проведены автоматическим способом с помощью анализатора ADAGIO (Bio-Rad Laboratories, США). Перед анализом ультраструктуры клинических изолятов S. aureus, обнаруживаемых в ЗПР, с помощью сканирующей электронной микроскопии (СЭМ) образцы были фиксированы в парах 10% раствора формалина в течение 1 суток. С поверхности зон подавления роста клинических изолятов и референсного штамма S. aureus произведены отпечатки на кремниевые пластины, которые затем были прикреплены к алюминиевым столикам с помощью двустороннего угольного скотча. На поверхность отпечатков было напылено золото толщиной 5 нм в установке "SPI-MODULE Sputter Coater" (SPI Supplies, США). Исследование было проведено с помощью сканирующего двулучевого электронного микроскопа Quanta 200 3D (FEI Company, США) в режиме высокого вакуума, при ускоряющем напряжении 5-10 кВ. По результатам определения чувствительности к антибиотикам диско-диффузионным методом, изученные штаммы клинических изолятов S. aureus, а также референсный штамм S. aureus АТСС 25923, были чувствительны ко всем использованным антибактериальным препаратам, кроме пенициллина. ЗПР при определении чувствительности к пенициллину для клинических изолятов отсутствовала, для референсного штамма S. aureus АТСС 25923 – составила 12 мм. Макроскопически все зоны подавления роста были полностью прозрачными, с четкой границей. Для контроля был использован штамм клинического изолята S. aureus, а также референсный штамм S. aureus АТСС 25923, подготовленные как и для постановки теста на чувствительность к антибиотикам, но без использования дисков с антибиотиками. Для определения жизнеспособности S. aureus после воздействия антибиотиков разных групп были проведены посевы из зон подавления роста всех использованных в работе штаммов на кровяной агар (BioMerieux, Франция). Результаты Результаты исследования ультраструктуры штаммов клинических изолятов, культивированных без присутствия антибиотиков и в зоне диффузии пенициллина. Контроль. В качестве контроля были изучены отпечатки бактериальных культур всех исследованных штаммов с агаризованной питательной среды Мюллер-Хинтон (Himedia Laboratories Pvt, Индия) без использования дисков с антибактериальными препаратами. Контрольные препараты были представлены многочисленными, многослойно расположенными бактериальными клетками сферической формы с ровными очертаниями и гладкой поверхностью, плотно прилежавшими друг к другу, имевшими средний размер 630 ± 40 нм (рис. 1 а). Часть из них имела сформированную перегородку деления. Все исследованные штаммы клинических изолятов были устойчивы к пенициллину, и визуально зона подавления роста не определялась. Бактериальные клетки S. аureus в препаратах, полученных из зоны диффузии пенициллина, располагались многослойно и морфологически не отличались от культивированных без присутствия антибиотиков (рис. 1 б). Рис. 1 а. Морфология штамма клинического изолята S. aureus, культивированного на питательной среде Мюллер-Хинтон без применения дисков с антибиотиками. Контроль. Рис. 1 б. Морфология штамма клинического изолята S. aureus, культивированного в зоне диффузии пенициллина.  Результаты исследования характера изменений ультраструктуры клинических изолятов S. aureus в условиях культивирования в присутствии антибактериальных препаратов различного механизма действия. Изучение отпечатков с зон подавления роста трех клинических изолятов S. Aureus с помощью сканирующей электронной микроскопии показало, что во всех образцах бактерии в том или ином количестве присутствовали на поверхности агаризованной питательной среды зоны подавления роста. Их количество постепенно уменьшалось по мере приближения к диску. Бактерии присутствовали также и в непосредственной близости от него. Спектр препаратов, используемых для оценки чувствительности к антибиотикам диско-диффузионным методом представлен препаратами различных фармакологических групп, отличающимися механизмом их воздействия на бактериальные клетки. Тем не менее, были зафиксированы общие признаки морфологических изменений S. aureus, регистрировавшиеся в зонах подавления роста под воздействием антибиотиков, к которым изученные штаммы клинических изолятов были чувствительны. В подавляющем большинстве образцов было отмечено присутствие микроорганизмов с измененной формой в диапазоне от сферической до дисковидной двояковогнутой (рис. 2 а). Следует отметить особенности выраженности этого признака в ЗПР различных антибиотиков. Так, в зонах воздействия клиндамицина, линезолида и эритромицина дисковидные формы S. aureus, представлявшие собой практически спавшиеся клеточные стенки, были выявлены в большом количестве. Наряду с ними в препарате сохранялись микроорганизмы сферической формы. В области зоны подавления роста, ближайшей к диску с антибиотиком, по-прежнему сохранялись как резко измененные, так и внешне сохранные формы бактериальных клеток, слой бактерий становился тоньше. В непосредственной близости к диску в препаратах отсутствовали дисковидные формы микроорганизмов, тогда как бактерии сферической формы сохранялись в значительном количестве. В ЗПР под воздействием офлоксацина и гентамицина дисковидные формы клеток были единичными и представлены в одном из трех клинических штаммов (рис. 2 б). В препаратах из зоны подавления роста под воздействием цефокситина дисковидные формы S. aureus не выявлены во всех клинических изолятах. Рис. 2 а. Сферические, уплощенные и дисковидные формы бактериальных клеток S. aureus в зонах подавления роста под воздействием эритромицина. Рис. 2 б. Единичные S. aureus дисковидной формы в зонах подавления роста под воздействием гентамицина среди сохранивших сферическую форму бактериальных клеток.  Кроме дисковидных, в препаратах встречались бактериальные клетки неправильных форм. В зонах подавления роста эритромицина, линезолида и офлоксацина полиморфизм был наиболее выражен (рис. 3 а и б). Рис. 3 а. Полиморфизм S. aureus в зоне подавления роста под воздействием линезолида. Рис. 3 б. Разнообразные формы S. aureus в зоне подавления роста под воздействием офлоксацина.  Следующим постоянным морфологическим признаком воздействия антибиотиков на микроорганизмы было изменение их размеров. Так, под воздействием эритромицина и клиндамицина средний размер сохранивших сферическую форму бактериальных клеток примерно в 1,5-2 раза превышал средний размер клеток S. aureus, культивируемых без взаимодействия с антибиотиками (0,6 мкм), и достигал значений до 1,23 мкм (рис. 4 а). В ЗПР в присутствии линезолида обращала на себя внимание диссоциация размеров бактериальных клеток в широких пределах от 400 нм до 1,3 мкм. (рис. 4 б). Рис. 4 а. Размеры S. aureus в зоне подавления роста под воздействием эритромицина в 1,5-2 раза превышают размеры интактных. Рис. 4 б. Выраженная диссоциация размеров бактериальных клеток S. aureus в присутствии линезолида. 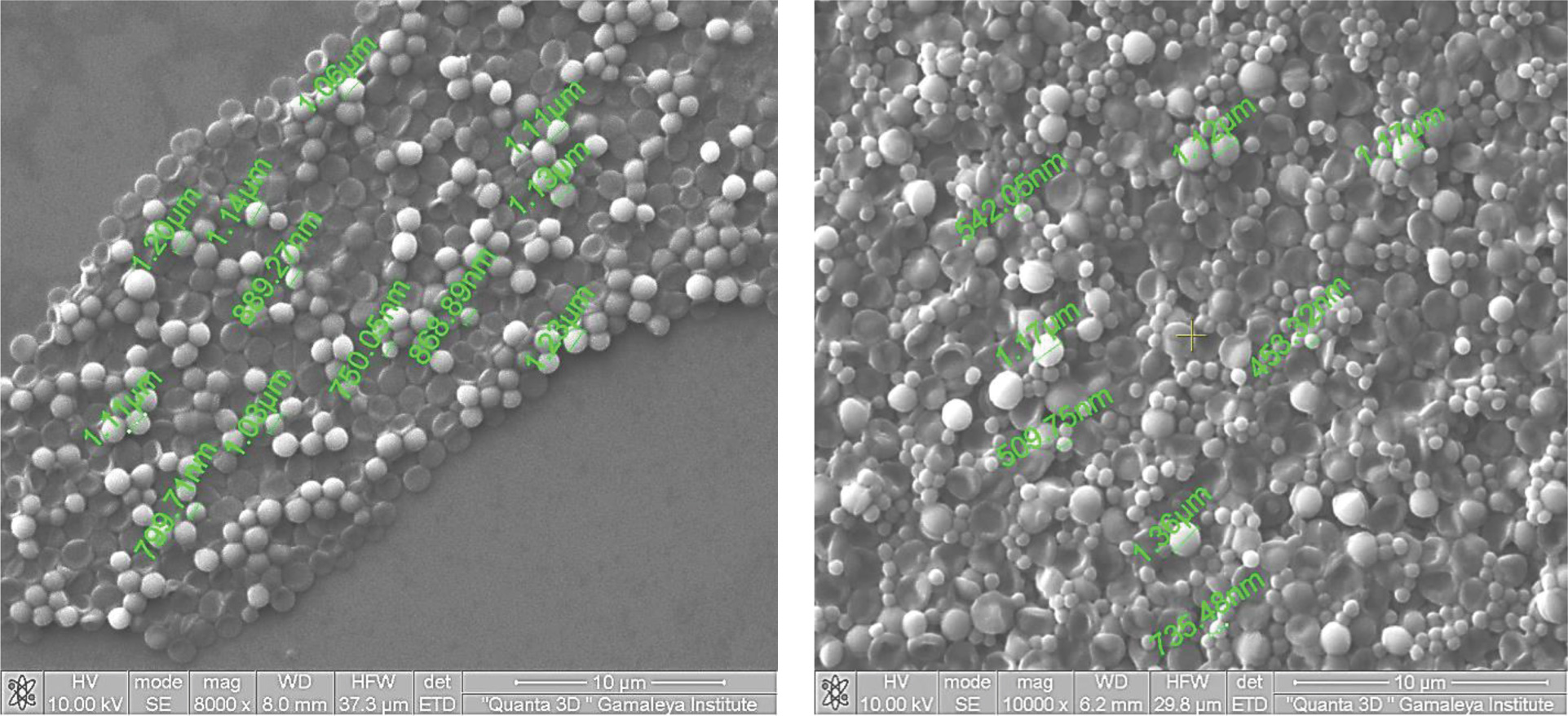 Под воздействием офлоксацина и гентамицина размеры бактериальных клеток от средних для интактных клеток в зоне роста изменялись в сторону увеличения – до 850-1000 нм, по мере приближения к диску. Иная тенденция была отмечена при культивировании S. aureus в присутствии цефокситина. В данном случае бактерии на всем протяжении ЗПР имели средний размер интактной бактериальной клетки S. aureus (600 нм) с небольшим диапазоном. Третьим признаком изменения морфофункционального состояния клеточной культуры S. aureus в описываемых условиях было наличие экзоклеточного матрикса, объединявшего бактериальные клетки между собой, что соответствует морфологическим критериям биопленки. В большинстве препаратов, в особенности в присутствии линезолида и офлоксацина, экзоклеточный матрикс был сформирован как непосредственно в области зоны подавления роста, так и за ее пределами (рис. 5 а и б). Рис. 5 а. Выраженный слой экзоклеточного матрикса на поверхности слоя S. aureus за пределами зоны подавления роста линезолидом. Рис. 5 б. Выраженный слой экзоклеточного матрикса на поверхности слоя S. aureus за пределами зоны подавления роста офлоксацином.  Количество и характер распределения экзоклеточного матрикса в зонах подавления роста штаммов клинических изолятов несколько отличались друг от друга и зависели от того, в присутствии какого антибиотика культивировались бактерии. Однако можно сказать, что общим признаком было разделение популяции бактерий: часть бактериальных клеток были сгруппированы и объединены экзоклеточным матриксом, другая часть располагалась единично, парами или группами без формирования матрикса (рис. 5 в и г). Рис. 5 в. Свободно расположенные и объединенные внеклеточным матриксом бактериальные клетки S. aureus в непосредственной близости к диску с линезолидом. Рис. 5 г. Свободно расположенные пары и объединенные внеклеточным матриксом группы S. aureus в ЗПР под воздействием гентамицина.  Следующим критерием оценки морфофункционального состояния S. aureus в условиях культивирования в присутствии антибиотиков стало наличие признаков деления бактерий. Сформированные перегородки деления в том или ином количестве были зафиксированы практически во всех исследованных образцах, как на периферии, так и в центре зоны подавления роста (рис. 6 а и б). Рис. 6 а. Сформированные перегородки деления S. aureus в ЗПР под воздействием клиндамицина. Рис. 6 б. Признаки деления S. aureus в ЗПР под воздействием гентамицина.  Использованная в исследовании техника отпечатков позволила получить изображение не только самих бактериальных клеток. Одновременно можно было оценить изменения в окружающей бактерии питательной среде, если в процессе культивирования на поверхности появлялись продукты жизнедеятельности или деградации клеток. В подавляющем большинстве препаратов были выявлены лишь редкие мелкие кристаллоподобные структуры вокруг скоплений бактериальных клеток. Отличались по этому признаку лишь препараты из зон подавления роста офлоксацина и цефокситина. Наряду с тем, что этим образцам были присущи все те признаки, которые описаны выше, с поверхности твердой питательной среды в некоторых участках были получены отпечатки значительного количества гомогенного вещества, морфологически идентичного экзоклеточному матриксу (рис.7 а и б). Кроме гомогенного, материал содержал и гранулярный компонент, со средним размером гранулы около 200 нм. Гранулы имели однородные размер, форму и электронную плотность, и в некоторых случаях признаки бинарного деления, что позволило отнести их к микроформам исследуемых бактерий (рис. 7 а и б). Рис.7 а. Гомогенное вещество (возможно, экзоклеточный матрикс) и гранулярный компонент на фоне морфологически сохранившихся бактериальных клетокS.aureus в условиях культивирования в присутствии офлоксацина. Рис. 7 б. Гомогенное вещество (возможно, экзоклеточный матрикс) и микроформы S. aureus в условиях культивирования в присутствии цефокситина.  Результаты изменений ультраструктуры референсного штамма S. aureus АТСС 25923 в условиях культивирования в присутствии подавляющих концентраций антибактериальных препаратов различного механизма действия. В контрольном препарате морфология бактериальных клеток референсного штамма S. aureus АТСС 25923, культивировавшегося без присутствия антибактериальных препаратов, не отличалась от бактериальных клеток штаммов клинических изолятов. Микроорганизмы, средний размер которых составил 630±30 нм, были правильной сферической формы, плотно прилежали друг к другу без формирования экзоклеточного матрикса. Изучение ультраструктуры референсного штамма S. aureus АТСС 25923 в условиях культивирования в присутствии антибактериальных препаратов выявило некоторые отличия их от штаммов клинических изолятов. Несмотря на подтвержденную устойчивость к воздействию пенициллина, зона подавления роста в случае воздействия его на референсный штамм S. aureus АТСС 25923 составляла 12 мм. В отпечатках из этой зоны были выявлены выраженные изменения морфологии бактериальных клеток в виде изменения формы, контуров, диссоциации размеров, наличия экзоклеточного матрикса. (Рис. 8) Рис. 8. Изменения морфологии бактериальных клеток S. aureus АТСС 25923 в зоне подавления роста при воздействии пенициллина. Бактериальные клетки S. aureus имели неправильную форму, наблюдалась диссоциация их размеров и наличие экзоклеточного матрикса.  Образование большого количества дисковидных форм бактерий в условиях культивирования в присутствии антибиотиков бактериостатического механизма действия для референсного штамма S. aureus не было столь характерным, как для штаммов клинических изолятов, а в зоне воздействия эритромицина дисковидные формы бактерий отсутствовали (рис.9). Рис. 9. Отсутствие дисковидных форм S. aureus АТСС 25923 в зоне воздействия эритромицина.  Обнаружено также отсутствие экзоклеточного матрикса при культивировании бактерий в зоне воздействия линезолида, что, в свою очередь, отличало морфологию референсного штамма от штаммов клинических изолятов (рис.10). Рис. 10. Отсутствие экзоклеточного матрикса, объединяющего клетки S. aureus АТСС 25923 в зоне воздействия линезолида.  Микроформы бактерий референсного штамма S. aureus АТСС 25923 не были выявлены в препаратах в присутствии цефокситина, в небольшом количестве определялись в препаратах под воздействием офлоксацина, тогда как во всех трех препаратах клинических штаммов обнаружены микроформы бактерий и гомогенный материал в ЗПР под воздействием обоих этих препаратов. Результаты определения жизнеспособности популяции S. aureus, сохранившихся в зонах подавления роста. Был получен рост S. aureus из ЗПР всех антибиотиков, за исключением гентамицина. Во всех случаях посевов из ЗПР, в том числе и у референсного штамма S. aureus АТСС 25923 после воздействия гентамицином, рост колоний на кровяном агаре отсутствовал. Обсуждение Результатом проведенного исследования стало выявление нескольких уровней изменений морфофункциональной организации популяции S. aureus в условиях ее культивирования в присутствии антибактериальных препаратов различного механизма действия. На уровне отдельной бактериальной клетки S. аureus признаками явились, в первую очередь, выраженные изменения формы и размеров. Под воздействием антибиотиков бактериостатического механизма действия форма большого количества бактериальных клеток S. аureus становилась дисковидной, представляя собой спавшуюся клеточную стенку бактерий в результате, вероятно, лизиса внутренних ее компонентов. Столь выраженное изменение морфологии не было характерно для S. aureus из зон подавления роста под воздействием антибактериальных препаратов с бактерицидным механизмом действия. В непосредственной близости с диском, содержавшим антибактериальный препарат, сохранялись только бактерии сферической формы. Что касается изменения размеров микроорганизмов, то выраженность этого признака также в большей степени была характерна для зон воздействия бактериостатическими антибиотиками. При этом обращало на себя внимание то, что изменения размеров бактериальных клеток имели разную направленность, то есть наряду с резко увеличенными, до 2 раз, присутствовали и значительно уменьшенные в размерах микроорганизмы. Возможно, что резкое увеличение их размеров являлось признаком перехода от физиологического состояния к началу процесса разрушения внутренних структур. Однако в литературе имеются сведения о возможном резком утолщении клеточной стенки бактерий под воздействием антибиотиков [6,7]. Поэтому не исключено, что этот процесс является составляющим механизма выживания и приспособления к условиям воздействия повреждающего фактора, к которым относится и антибактериальный препарат. Примененная техника получения отпечатков позволила также охарактеризовать изменения морфологии S. aureus в описываемых условиях на уровне межклеточного взаимодействия. Стало, в частности, очевидно, что воздействие антибактериальных препаратов активирует процессы выработки экзоклеточного матрикса, то есть способствует образованию биопленки. Эти факты являются иллюстрациями к результатам исследований, проведенным ранее другими авторами с помощью других методов [6,11,12,20,21]. Что касается изменений на уровне популяции, то следует отметить, что, по результатам электронно-микроскопического исследования, несмотря на резкое снижение численности в условиях культивирования в присутствии антибиотиков, часть популяции сохраняет структурные признаки, присущие интактным бактериальным клеткам, способность к делению и формированию биопленки. С большой долей вероятности можно говорить, что морфологически сохранные бактериальные клетки представляют собой так называемые "персистеры" (переживающие формы), которые могут играть значимую роль в условиях in vivo [8,9,13-17]. В нашем исследовании это успешно подтверждено бактериологическим методом, с помощью которого удалось доказать жизнеспособность этой части популяции. Продукты жизнедеятельности бактерий, которые обнаружены в зонах подавления роста, могут содержать антигенные структуры, небезразличные для организма, в случае их образования в условиях in vivo. Каковы роль и клиническое значение выявленных в результате исследования микроформ бактерий, сформировавшихся в условиях культивирования в присутствии офлоксацина и цефокситина, остается неясным. Можно предполагать, что они представляют собой некие переходные формы, способные, в зависимости от условий, осуществить тот или иной сценарий развития бактериальной клетки. Исследование показало, что морфофункциональные изменения референсного штамма S. aureus АТСС 25923 не полностью идентичны изменениям, описанным для клинических изолятов. Возможно, это свидетельствует об изменении приспособительных механизмов в результате их длительного культивирования. Заключение В результате проведенного исследования был выявлен широкий спектр морфологических изменений S. aureus, происходивших под влиянием антибактериальных препаратов. Были обнаружены следующие морфологические проявления фенотипической изменчивости S. аureus в условиях культивирования в присутствии антибактериальных средств: 1. В зонах подавления роста, под воздействием использованных в исследовании антибиотиков, к которым S. aureus был чувствителен, на поверхности питательной среды обнаруживались как морфологически сохранные, так и структурно измененные бактериальные клетки. Количество бактериальных клеток уменьшалось по мере приближения к диску, содержащему антибиотик. 2. Наиболее общим признаком для штаммов клинических изолятов S. aureus, явилось формирование большого количества бактериальных клеток специфической дисковидной формы в зонах воздействия антибиотиков бактериостатического механизма действия. В условиях применения бактерицидных препаратов часть популяции сохраняла сферическую форму, другая часть имела неправильные очертания. 3. Изменения размеров бактериальных клеток в зонах подавления роста имели разнонаправленный характер, иногда в пределах зоны воздействия одного антибиотика. Этот признак также не был строго специфичным. При воздействии цефокситина не было выявлено значимых изменений размеров микроорганизмов. 4. Культивирование бактерий в присутствии антибактериальных препаратов стимулировало выработку экзоклеточного матрикса в разной степени, в зависимости от вида антибактериального препарата. 5. В зонах подавления роста клинических изолятов S. aureus под воздействием цефокситина и офлоксацина, кроме описанных признаков, были выявлены как свободно расположенные микроформы бактерий, так и их скопления, покрытые экзоклеточным матриксом. 6. Фенотипическая изменчивость референсного штамма S. aureus АТСС 25923 характеризовалась в целом теми же признаками, но не полностью соответствовала конкретным изменениям морфологии бактериальных клеток штаммов клинических изолятов, несмотря на стандартизованные условия проведенного исследования. Таким образом референсный штамм S. aureus АТСС 25923 может быть моделью для ультраструктурных исследований, но следует учитывать, что его морфологические характеристики могут не отражать в полной мере спектра изменений других штаммов, в частности, полученных из клинического материала. 7. Жизнеспособность сохранившихся в зонах подавления роста бактерий была доказана при посевах из ЗПР во всех случаях, кроме зоны подавления роста под воздействием гентамицина. Таким образом, проведенное исследование выявило характер изменений ультраструктуры S. аureus в стандартизированных условиях проведения теста на чувствительность к антибиотикам как проявлений фенотипической изменчивости микроорганизмов в ответ на присутствие различных по механизму действия антибактериальных препаратов. Анализ полученных результатов свидетельствует о том, что при электронно-микроскопических исследованиях клинического или экспериментального материала микроорганизмы одного вида могут быть представлены бактериальными клетками с широким спектром морфологических характеристик, проявляя тем самым, в частности, способность к фенотипической изменчивости в ответ на разнообразные факторы внешнего воздействия. Представляется немаловажным учитывать эти данные для адекватной оценки и анализа результатов электронно-микроскопических исследований клинического и экспериментального материала. Список литературы 1. Афанасьев М.В., Миронова Л.В., Басов Е.А., Остяк А.С., Куликалова Е.С., Урбанович Л.Я., Балахонов С.В. MALDI-TOF масс-спектрометрический анализ в ускоренной идентификации микроорганизмов рода Vibrio. Молекулярная генетика, микробиология и вирусология. 2014; 3:22-30. 2. Клинические рекомендации определения чувствительности микроорганизмов к антимикробным препаратам (версия 2015-02). 3. Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания 4.2.1890-04. М.: Федеральный центр госсанэпиднадзора Минздрава России, 2004. 4. Cohen N.R., Lobritz M.A., Collins J.J. Microbial persistence and the road to drug resistance. Cell Host & Microbe 2013; 13(6): 632-642. 5. Cosgrove S.E. The relationship between antimicrobial resistance and patient outcomes: mortality, length of hospital stay, and health care costs. Clin Infect Dis. 2006; 42 (Suppl 2): 82-9. 6. Elliott G.R, Peterson P.K, Verburg H.A, Freiberg M.R, Hoidal J.R, Quie P.G. Influence of subinhibitory concentrations of penicillin, cephalothin, and clindamycin on Staphylococcus aureus growth in human phagocytic cells. Antimicrob Agents Chemother. 1982; Nov.22(5): 781-784. 7. Elliott T.S., Greenwood D., Rodgers F.G., O’Grady F. The response of Staphylococcus aureus to benzylpenicillin. Br J ExpPathol. 1979; Feb. 60(1):14-23 8. Fauvart M., De Groote V.N., Michiels J. Role of persister cells in chronic infections: clinical relevance and perspectives on anti-persister therapies. Journal of Medical Microbiology 2011; 60: 699-709. 9. Gefen, O., Balaban N.Q. The importance of being persistent: heterogeneity of bacterial populations under antibiotic stress. FEMS Microbiol. Rev.2009; 33: 704-717. doi: 10.1111/j.1574-6976.2008.00156.x 10. Hatano K., Nishino T. Morphological alterations of Staphylococcus aureus and Streptococcus pyogenes exposed to cefdinir, a new oral broad-spectrum cephalosporin. Chemotherapy 1994; 40(2):73-9. 11. Hoffman L.R., D`Argenio D.A., MacCoss M.J., Zhang Z., Jones R.A, Miller S.I. Aminoglycoside antibiotics induce bacterial biofilm formation. 2005; Nature 436: 1171-1175. 12. Kaplan JB. Antibiotic-induced biofilm formation. Int.J. Artiff. Organs 2011; Sept 34(9): 737-51. 13. Kell D., Potgieter M., Pretorius E. Individuality, phenotypic differentiation, dormancy and ‘persistence’ in culturable bacterial systems: commonalities shared by environmental, laboratory, and clinical microbiology. F1000 Res. 2015; 4: 179. doi: 10.12688/f1000research.6709.2 14. Lewis, K. Persister cells, dormancy and infectious disease. Nat. Rev. Microbiol.2007; 5: 48–56. doi: 10.1038/nrmicro1557 15. Lewis K. Multidrug tolerance of biofilms and persister cells. Curr Top Microbiol Immunol. 2008; 322:107-31. 16. Lewis K. Persister cells. Annu Rev Microbiol. 2010; 64:357-72. 17. Lewis K. Persister cells: molecular mechanisms related to antibiotic tolerance.Handb Exp Pharmacol. 2012; (211):121-33. 18. Lowy F.D. Staphylococcus aureus infections. N Engl J Med. 1998; 339(8):520-32 19. Munita J.M., Arias C.A. Mechanisms of Antibiotic Resistance. Microbiol Spectr. 2016; 4 (2) doi: 10.1128/microbiolspec.VMBF-0016-2015 20. Peterson E, Kaur P. Antibiotic Resistance Mechanisms in Bacteria: Relationships Between Resistance Determinants of Antibiotic Producers, Environmental Bacteria, and Clinical Pathogens. Front Microbiol. 2018; 9: 2928. doi:10.3389/fmicb.2018.02928 21. Rachid S., Ohlsen K., Witte W., Hacker J., Ziebuhr W. Effect of subinhibitory antibiotic concentrations on polysaccharide intercellular adhesin expression in biofilm-forming Staphylococcus epidermidis. Antimicrob. Agents Chemother. 2000; 44: 3357-3363. 22. Sianglum W., Srimanote P., Wonglumsom W., Kittiniyom K., Voravuthikunchai S.P. Proteome analyses of cellular proteins in methicillin-resistant Staphylococcus aureus treated with rhodomyrtone, a novel antibiotic candidate. PLoS One. 2011;6(2): e16628. Published 2011 Feb 4. doi: т10.1371/journal.pone.0016628 23. Stapleton P.D., Taylor P.W. Methicillin resistance in Staphylococcus aureus: mechanisms and modulation. SciProg. 2002; 85(Pt 1):57-72. 24. Tong S.Y., Davis J.S., Eichenberger E., Holland T.L., Fowler V.G. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management. Clin Microbiol Rev. 2015; 28(3): 603-61. doi:10.1128/CMR.00134-14 25. Zhu X, Liu D, Singh A.K., et al. Tunicamycin Mediated Inhibition of Wall Teichoic Acid Affects Staphylococcus aureus and Listeria monocytogenes Cell Morphology, Biofilm Formation and Virulence. Front Microbiol. 2018; 9:1352. doi:10.3389/fmicb.2018.01352
Corresponding author: Shevlyagina Natalia; email: microbanatomy@gmail.com. Conflict of interest. None declared. Funding. The study had no sponsorship. Abstract The search for new methods for identifying the pathogen in biological material, including microscopic, remains relevant. The study of ultrastructural changes of microorganisms as a result of exposure to various groups of antibiotics is important, because the morphology of the bacterial cell varies considerably depending on the conditions of cultivation. The purpose of the study: 1. To identify the nature of changes in the ultrastructure of preserved bacterial cells of S. aureus, cultivated in the presence of antibiotics. 2. To determine the viability of that part of the population of S. aureus, which remained exposed to suppressive concentrations of antibacterial drugs. 3. To determine whether the ultrastructural changes of the reference strain S. aureus ATCC 25923 in the proposed conditions completely reflect the nature of these changes for strains isolated from clinical material. Materials and methods. Three strains of S. aureus isolated from biological material and the reference strain S. aureus ATCC 25923 were used to investigate the S. aureus ultrastructure. The analysis was carried out on the basis of data obtained using scanning electron microscopy (SEM). In the process of sample preparation, the technique of imprinting bacteria from agarized nutrient medium was applied. Results and conclusions. The most common feature for the strains of clinical isolates of S. aureus was the formation of a large number of bacterial cells of a specific disc-shaped form in zones of influence of bacteriostatic antibiotics. In terms of the use of bactericidal drugs, part of the population remained spherical, the other part had irregular contours. Changes in the size of bacterial cells in growth suppression zones were multidirectional. Cultivation of bacteria under conditions of exposure to suppressive concentrations of antibacterial drugs stimulated the production of exocellular matrix. The ultrastructural changes of phenotypic variability of the reference strain S. aureus ATCC 25923 did not fully correspond to changes in the morphology of the bacterial cells of the strains of clinical isolates. The viability of bacteria remaining in the zones of growth suppression has been confirmed in all cases of antibiotic exposure, except gentamicin. Thus, the study revealed the nature of changes in the ultrastructure of S. aureus as manifestations of phenotypic variability of microorganisms in response to the presence of antibacterial drugs with different mechanisms of action. Key words ultrastructure of S. aureus, antibacterial drugs, scanning electron microscopy, phenotypic variability of S. aureus, biofilm References 1. Afanas'ev M.V., Mironova L.V., Basov E.A., Ostyak A.S., Kulikalova E.S., Urbanovich L.Ya., Balakhonov S.V. MALDI-TOF mass-spektrometricheskiy analiz v uskorennoy identifikatsii mikroorganizmov roda Vibrio. [MAL'DI-TOF mass spectrometry analysis in the accelerated identification of microorganisms of the genus Vibrio]. Molekulyarnaya genetika, mikrobiologiya i virusologiya. [Molecular genetics, microbiology and virology].2014; 3:22-30. (In Russ.) 2. Klinicheskie rekomendatsii opredeleniya chuvstvitel'nosti mikroorganizmov k antimikrobnym preparatam (versiya 2015-02). [Determination of the sensitivity of microorganisms to antimicrobial drugs (version 2015-02)]. (In Russ.) 3. Methodological guidelines 4.2.1890-04. (In Russ.) 4. Cohen N.R., Lobritz M.A., Collins J.J. Microbial persistence and the road to drug resistance. Cell Host & Microbe 2013; 13(6): 632-642. 5. Cosgrove S.E. The relationship between antimicrobial resistance and patient outcomes: mortality, length of hospital stay, and health care costs. Clin Infect Dis. 2006; 42 (Suppl 2): 82-9. 6. Elliott G.R, Peterson P.K, Verburg H.A, Freiberg M.R, Hoidal J.R, Quie P.G. Influence of subinhibitory concentrations of penicillin, cephalothin, and clindamycin on Staphylococcus aureus growth in human phagocytic cells. Antimicrob Agents Chemother. 1982; Nov.22(5): 781-784. 7. Elliott T.S., Greenwood D., Rodgers F.G., O’Grady F. The response of Staphylococcus aureus to benzylpenicillin. Br J ExpPathol. 1979; Feb. 60 (1):14-23. 8. Fauvart M., De Groote V.N., Michiels J. Role of persister cells in chronic infections: clinical relevance and perspectives on anti-persister therapies. Journal of Medical Microbiology 2011; 60: 699-709. 9. Gefen, O., Balaban, N.Q. The importance of being persistent: heterogeneity of bacterial populations under antibiotic stress. FEMS Microbiol. Rev.2009; 33: 704-717. doi: 10.1111/j.1574-6976.2008.00156.x 10. Hatano K., Nishino T. Morphological alterations of Staphylococcus aureus and Streptococcus pyogenes exposed to cefdinir, a new oral broad-spectrum cephalosporin. Chemotherapy 1994; 40 (2): 73-9. 11. Hoffman L.R., D`Argenio D.A., MacCoss M.J., Zhang Z., Jones R.A, Miller S.I. Aminoglycoside antibiotics induce bacterial biofilm formation. 2005; Nature 436: 1171-1175. 12. Kaplan JB. Antibiotic-induced biofilm formation. Int. J. Artiff. Organs 2011; Sept 34(9): 737-51. 13. Kell D., Potgieter M., Pretorius E. Individuality, phenotypic differentiation, dormancy and ‘persistence’ in culturable bacterial systems: commonalities shared by environmental, laboratory, and clinical microbiology. F1000 Res. 2015; 4: 179. Published 2015 Sep 7 doi: 10.12688/f1000research.6709.2 14. Lewis, K. Persister cells, dormancy and infectious disease. Nat. Rev. Microbiol. 2007; 5: 48–56. doi: 10.1038/nrmicro1557 15. Lewis K. Multidrug tolerance of biofilms and persister cells. Curr Top Microbiol Immunol. 2008; 322:107-31. 16. Lewis K. Persister cells. Annu Rev Microbiol. 2010; 64:357-72. 17. Lewis K. Persister cells: molecular mechanisms related to antibiotic tolerance. Handb Exp Pharmacol. 2012; (211):121-33. 18. Lowy F.D. Staphylococcus aureus infections. N Engl J Med. 1998; 339 (8): 520-32 19. Munita J.M., Arias C.A. Mechanisms of Antibiotic Resistance. Microbiol Spectr. 2016; 4 (2) doi: 10.1128/microbiolspec.VMBF-0016-2015 20. Peterson E, Kaur P. Antibiotic Resistance Mechanisms in Bacteria: Relationships Between Resistance Determinants of Antibiotic Producers, Environmental Bacteria, and Clinical Pathogens. Front Microbiol. 2018; 9: 2928. doi:10.3389/fmicb.2018.02928 21. Rachid S., Ohlsen K., Witte W., Hacker J., Ziebuhr W. Effect of subinhibitory antibiotic concentrations on polysaccharide intercellular adhesin expression in biofilm-forming Staphylococcus epidermidis. Antimicrob. Agents Chemother. 2000; 44: 3357-3363. 22. Sianglum W., Srimanote P., Wonglumsom W., Kittiniyom K., Voravuthikunchai S.P. Proteome analyses of cellular proteins in methicillin-resistant Staphylococcus aureus treated with rhodomyrtone, a novel antibiotic candidate. PLoS One. 2011;6(2): e16628. doi: 10.1371/journal.pone.0016628 23. Stapleton P.D., Taylor P.W. Methicillin resistance in Staphylococcus aureus: mechanisms and modulation. SciProg. 2002; 85(Pt 1):57-72. 24. Tong S.Y., Davis J.S., Eichenberger E., Holland T.L., Fowler V.G. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management. Clin Microbiol Rev. 2015;28(3):603-61. doi: 10.1128/CMR.00134-14 25. Zhu X, Liu D, Singh A.K., et al. Tunicamycin Mediated Inhibition of Wall Teichoic Acid Affects Staphylococcus aureus and Listeria monocytogenes Cell Morphology, Biofilm Formation and Virulence. Front Microbiol. 2018; 9:1352. Published 2018 Jul 2. doi: 10.3389/fmicb.2018.01352 |
[ См. также ] Рубрики |
||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|