| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Перспективы снижения гастротоксичности противовоспалительной и обезболивающей терапии в аспекте применения амтолметин гуацила
Автор для корреспонденции: Коньшина Татьяна Михайловна; e-mail: tmkpharm@mail.ru. Финансирование. Исследование не имело спонсорской поддержки. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Аннотация Важнейшая проблема нестероидных противовоспалительных препаратов (НПВП) – высокий риск ульцерогенности. Один из механизмов её снижения – повышение в слизистой оболочке желудка (СОЖ) концентрации гастропротектора NO. В 2013 году в России зарегистрирован новый НПВП Амтолметин гуацил (АМГ). Он позиционируется как эффективное средство с гастропротекторным действием. АМГ в желудке стимулирует капсаициновые рецепторы и накапливает NO. Однако, данные по безопасности и эффективности АМГ немногочисленны. При его метаболизме образуется высоко ульцерогенный толметин. Целью нашего исследования было изучение противовоспалительного, обезболивающего и ульцерогенного эффекта АМГ после внутрижелудочного введения. Опыты проведены на белых нелинейных крысах и мышах обоего пола. Наше исследование показало, что АМГ эффективно снижает выраженность каррагенинового отека лапы крысы и уменьшает количество уксусных корчей у мышей. После 4-х дневного введения АМГ крысам в дозе 200 мг/кг 1 раз в сутки слизистая оболочка желудка у большинства животных оказалась без патологических изменений, единичные неглубокие эрозии без инфильтрации были обнаружены у 32% животных. Диклофенак в тех же условиях в дозе 10 мг/кг вызвал глубокие дефекты у 75% крыс. АМГ показал выраженную анальгетическую и противовоспалительную активность. Наши результаты подтвердили также преимущество АМГ в сравнении с диклофенаком по влиянию на СОЖ. Ключевые слова нестероидные противовоспалительные препараты, амтолметин гуацил, ульцерогенность, гастротоксичность, диклофенак doi: 10.29234/2308-9113-2020-8-4-13-24 Для цитирования: Коньшина Т. М., Голдобина Г. В., Болотская Н. В., Бурлуцкая А. А., Хоринко В. П., Коньшина Ю. А. Перспективы снижения гастротоксичности противовоспалительной и обезболивающей терапии в аспекте применения амтолметин гуацила. Медицина 2020; 8(4): 13-24. Введение Нестероидные противовоспалительные препараты (НПВП) на протяжение многих десятилетий сохраняют лидирующие позиции среди анальгетиков и противовоспалительных препаратов по частоте и широте клинического использования [6,13,15]. НПВП многофункциональны по применению благодаря своей способности оказывать как симптоматические, так и патогенетические терапевтические эффекты: жаропонижающий, обезболивающий, противовоспалительный, в добавление к этому, широту применения этой группы увеличивает использование ацетилсалициловой кислоты в качестве антитромботического средства [2,10,14]. Однако, применение НПВП небезопасно из-за высокой частоты нежелательных реакций, прежде всего, со стороны желудочно-кишечного тракта (ЖКТ), в том числе ульцерогенности [2,12,21]. Поражения гастро-дуоденальной зоны, а также других отделов тонкого кишечника, обусловленные приемом НПВП, приобретают характер нарастающей эпидемии и представляют серьезную медико-социальную проблему [18,22]. Высокий риск осложнений связан, в том числе, с распространенной практикой самолечения препаратами из большого списка НПВП, отпускаемых без рецепта [2]. В литературе приводятся впечатляющие данные частоты поражений ЖКТ: диспепсии встречаются у 30-40 % принимающих НПВП, эрозии и язвы – у 10-20%, перфорации и кровотечения – у 2-5%. Около 50% острых желудочно-кишечных кровотечений связаны с приемом НПВП. При продолжающемся приеме НПВП на фоне изъязвлений кровотечения встречаются в 40% случаев [2,15]. Особенно высок риск серьезных повреждений у пожилых больных, имеющих коморбидный фон, причем у таких пациентов в 60% случаев наблюдается отсутствие симптоматики при развивающейся НПВП-гастро-энтеропатологии [1,2]. Разработаны методы профилактики гастротоксичности НПВП, среди которых эффективно и наиболее популярно применение ингибиторов протоновой помпы (ИПП), надежно и длительно выключающих секрецию соляной кислоты, ведущего фактора агрессивности желудочного сока [11]. Добавление ИПП к НПВП, к сожалению, не способствует энтеропротекции, а напротив, способствует развитию тонкокишечных дисбиозов, псевдомембранозного колита, мальабсорбции, дефициту витамина В12, гипомагниемии; блокирует микросомальные печеночные ферменты, изменяя тем самым терапевтическую и токсическую активность других препаратов [21]. Не вполне решает проблему осложнений со стороны ЖКТ, вызванных приемом НПВП, группа высокоселективных (специфических) блокаторов циклооксигеназы-2 (ЦОГ-2, COX-2) – целекоксиб, эторикоксиб. По-видимому, это связано с нарушением синтеза ЦОГ-2-зависимых простагландинов, способствующих регенерации слизистой оболочки желудка (СОЖ) и кишечника. Кроме того, специфические-ЦОГ-2 блокаторы утяжеляют сердечно-сосудистую патологию, увеличивают риск тромбозов, нарушений сердечного ритма [2]. Известно, что в основе механизма НПВП-гастро-энтеротоксичности лежит уменьшение образования факторов защиты слизистой оболочки в связи с блокадой синтеза простагландинов. Некоторые НПВП также нарушают продукцию оксида азота (NO), снижая активность NO-синтетазы [8]. В этой связи важна разработка методов профилактики, связанных с усилением естественных защитных механизмов слизистой оболочки ЖКТ [1]. Одним из возможных путей снижения ульцерогенности НПВП является повышение концентрации NO в СОЖ. Известно, что NO выполняет защитную функцию в СОЖ: усиливает кровоток, способствует ангиогенезу, уменьшает агрегацию тромбоцитов, улучшает регенерацию клеток, повышает секрецию слизи и бикарбонатов, несколько снижает секрецию соляной кислоты, снижает миграцию нейтрофилов в эндотелиальные клетки, препятствует развитию воспаления, блокирует свободно-радикальные процессы [12,13,16]. Разработан ряд NO-высвобождающих дериватов НПВП-донаторов оксида азота, оказывающих менее выраженное повреждение СОЖ, например напроксинод, который является комбинацией напроксена и NO. Однако, данное средство, как и подобные другие (NO-кетопрофен, NO-диклофенак, NO-флурбипрофен), получившие название NO-НПВП или "CINODs" – COX-inhibiting nitric oxide donators, не нашли широкого практического применения [10, 16]. Актуальность В 2013 году в России зарегистрирован новый НПВП амтолметин гуацил (АМГ), полученный путем добавления к молекуле толметина гваякола и глицина. Толметин известен как активное неселективное по блокаде ЦОГ противовоспалительное средство для лечения ревматических заболеваний, купирования боли различного происхождения [11]. АМГ, имеющий в структуре ванилиновую группу, взаимодействует с капсаициновыми (ванилоидными) рецепторами СОЖ, что приводит к подавлению активности ингибиторов NO-синтетазы и накоплению NO в слизистой желудка [2,13]. В отличие от CINODs, при приеме АМГ не происходит повышения уровня NO в системном кровотоке, так как АМГ быстро гидролизуется эстеразами до толметина и других метаболитов, не способных активировать синтез NO. Локальное повышение синтеза NO позволяет избежать проявления его резорбтивного действия [2,13,14]. При приеме АМГ наблюдается значительно менее выраженное поражение СОЖ, чем при использовании толметина или других неселективных НПВП [13,18]. В самой структуре АМГ заложен гастропротективный эффект, компенсирующий гастротоксичность толметина. В эксперименте на животных АМГ, в отличие от других НПВП, не вызывал адгезию лейкоцитов к эндотелию, сужения сосудов и некроза СОЖ [16]. Была показана и дозозависимая гастропротекторная активность АМГ от повреждающего действия этанола и индометацина [11,13,16]. В клинических исследованиях АМГ существенно превосходил неселективные НПВП по профилю желудочно-кишечной безопасности [2,6,9]. Он показал хорошую переносимость при длительном приеме, не уступал по терапевтической эффективности целекоксибу, проявил противовоспалительную активность при анкилозирующем спондилите, не отвечающем на другие НПВП [3-5,19]. Для реализации максимальной гастропротективной активности АМГ рекомендуют принимать натощак, так как активация капсаициновых рецепторов происходит при прямом контакте лекарства со СОЖ [20]. Фармакоэкономически АМГ оказался дешевле комбинации неселективных НПВП с ИПП [8,11]. АМГ рекомендуется в качестве более безопасной альтернативы "традиционным" НПВП. Он представляется перспективным у коморбидных больных и при гастро-интестинальных рисках [1,19]. Однако, на сегодняшний день известно мало работ по параметрам безопасности и эффективности АМГ, а имеющиеся данные весьма противоречивы [2,11,20]. Цель исследования Это и определило цель нашего исследования – в эксперименте на лабораторных животных изучить амтолметин гуацил на наличие группоспецифических эффектов, как терапевтических (противовоспалительного, анальгетического), так и нежелательного побочного – ульцерогенного. Материалы и методы исследования Опыты проведены согласно методическим рекомендациям, изложенным в Руководстве по проведению доклинических исследований лекарственных средств [17]. Исследования выполняли в соответствие с международными принципами гуманного обращения с лабораторными животными [7,17]. Группы животных формировали с помощью простого рандомизирования. Во всех исследованиях АМГ и вещества сравнения вводили животным через металлический атравматичный зонд в желудок в виде водной взвеси из расчета 0,5 мл на 100 гр. массы тела. При определении анальгетической активности по методике "уксусных корчей" на 18-ти беспородных белых мышах АМГ вводили в дозе 100 мг/кг за 1 час до внутрибрюшинной инъекции альгогена. При исследовании противовоспалительной активности на модели каррагенинового отека задних лап 16-ти белых беспородных крыс АМГ вводили в дозе 200 мг/кг за 1 час до субплантарной инъекции флогогена. Исследование ульцерогенности проведено на 20-ти белых беспородных крысах при введении веществ внутрижелудочно 1 раз в сутки в утренние часы на протяжении 4-х дней. АМГ или препарат сравнения диклофенак вводили соответственно двум опытным группам животных, контрольной группе вводили эквиобъемное количество воды. Разовые дозы препаратов были выбраны близкими к их средним эффективным дозам по каррагениновому тесту: АМГ 200 мг/кг, диклофенак 10 мг/кг. Через 3 часа после последнего введения животных наркотизировали летальными дозами эфира и проводили патологоанатомическое и гистологическое исследования. Желудок (с начальной частью тонкого кишечника) извлекали, рассекали по малой кривизне, изучали состояние слизистой оболочки с помощью лупы при 6-кратном увеличении. Оценку состояния желудка проводили при помощи бальной шкалы, площадь язв на слизистой оболочке желудка определяли планиметрическим методом с использованием пленки с масштабно-координатной сеткой [7]. Гистологическое исследование желудка проводили при 40-кратном увеличении с окраской гематоксилин-эозином. Полученные данные обрабатывали статистически с использованием пакета программ Microsoft Office Excel 2007. Определяли среднюю арифметическую, ее стандартную ошибку, среднее квадратическое отклонение и доверительные интервалы. Для оценки достоверности средних значений в группах и достоверности различий между группами использовали критерий Стьюдента для независимых выборок. Критерием статистической достоверности считали величину р <0,05. В процессе анализа ульцерогенного действия прибегали также к определению достоверности отличий между группами по непараметрическому критерию U (Вилкоксона – Манна – Уитни), ориентируясь на р <0,05. Результаты исследования и их обсуждение Нами была выявлена высокая противовоспалительная активность АМГ. В опытах на крысах он достоверно уменьшал экссудацию на 69,37% (р =0,03) по сравнению с контролем через 3 часа после инъекции каррагенина. Столь же мощное подавление воспаления сохранилось и через 5 часов после введения флогогена и выразилось в уменьшении отека стопы на 72,03% (р=0,02) по сравнению с контролем. Полученные данные определения противовоспалительного действия по каррагениновому тесту приведены в таблице 1. При изучении анальгетического эффекта АМГ уменьшал количество корчей на 54,3%. Показатели средних значений и различия между опытной и контрольной группами являются статистически значимыми (р <0,05). Таблица 1. Результаты изучения противовоспалительной активности АМГ после введения каррагенина
При субхроническом введении АМГ у большинства животных слизистая оболочка желудка и тонкого кишечника оказались без патологических изменений (рис. 1), у 32% животных обнаружены единичные неглубокие эрозии без инфильтрации. Отмечается оставшееся в желудке большое количество АМГ, несмотря на прошедшие 3 часа после последнего введения препарата. Рис. 1. Слизистая оболочка желудка на фоне применения найзилата. 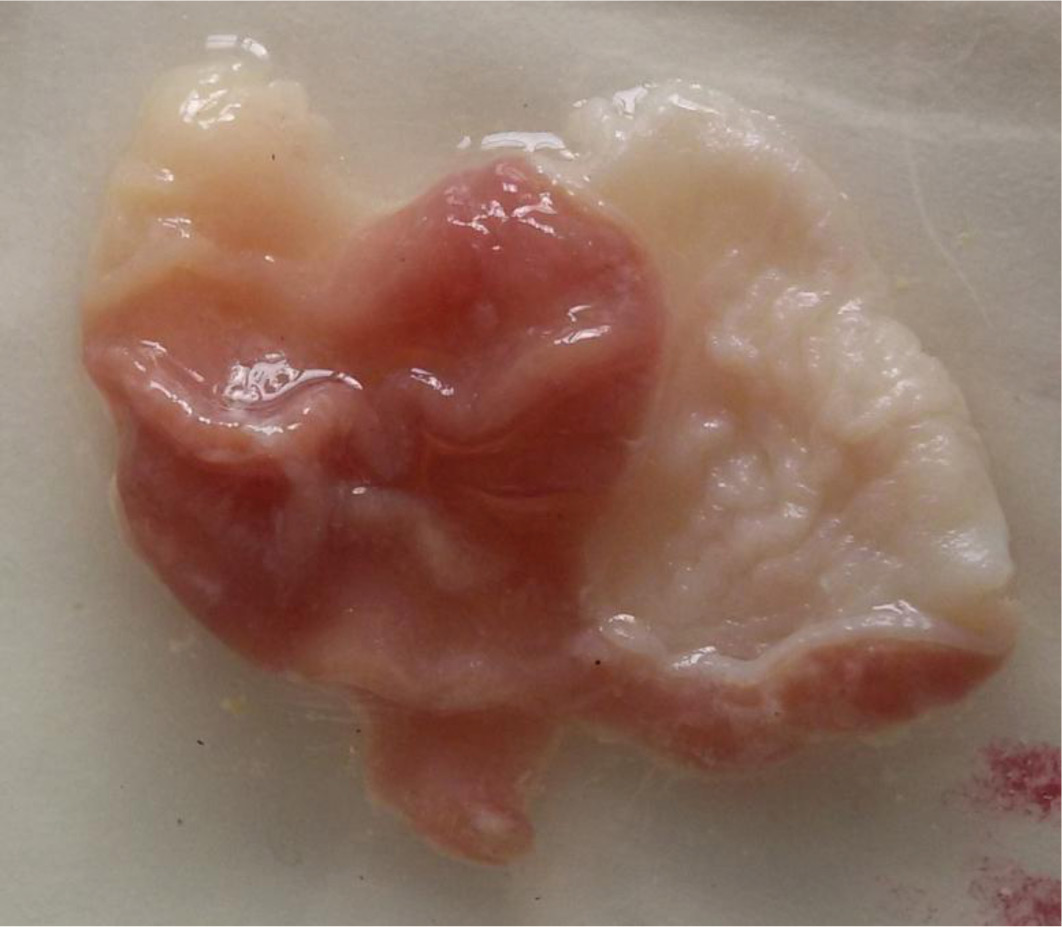 Это согласуется с данными литературы, показывающими нахождение в желудке АМГ спустя 4 часа после его введения [13]. Кстати, этим объясняют длительный гастропротективный эффект исходной молекулы. Среднее значение ульцерогенности АМГ по 4-х бальной шкале [7] равно 0,52 ±0,29 (р ˃0,05). Рассчитан индекс I0 обширности эрозивных дефектов. I0= S/N (где S-суммарная площадь эрозий в среднем из расчета на 1 животное в мм2, N-количество язвенных дефектов, штук на 1 животное). I0 (АМГ)= 0,64 мм2/0,4 =1,6 (табл. 2). Таблица 2. Результаты изучения ульцерогенности АМГ и диклофенака
В группе контроля слизистая оболочка желудка и тонкого кишечника оказалась без патологических изменений. тогда как диклофенак вызвал эрозии и кровоизлияния у 75% крыс (у вдвое большего количества животных, чем АМГ). Среднее значение ульцерогенности диклофенака по 4-х бальной шкале оказалось достоверным (р <0,05) и составило 1,70 ± 0,40 (то есть в 3 раза выше, чем у АМГ). Статистическая точность различия этого показателя ульцерогенности между группами, принимавшими АМГ и диклофенак, оказалась на грани достоверности: р=0,06 по критерию Стьюдента и р =0,05 по непараметрическому критерию U (Вилкоксона – Манна – Уитни). Индекс обширности эрозий I0 (диклофенака) = 2,56 (то есть в 1,6 раз больше, чем у АМГ). Причем дефекты от диклофенака оказались более обширными по площади, более глубокими (рис. 2, 3), с разрушением всех слоев слизистой, включая мышечную пластинку, повреждения сопровождались инфильтрацией лейкоцитами, отеком, в единичном случае очагом некроза в центре. Обнаруженные изменения согласуются с общеизвестными данными о способности диклофенака оказывать ульцерогенное действие. Рис. 2. Слизистая оболочка желудка на фоне применения диклофенака 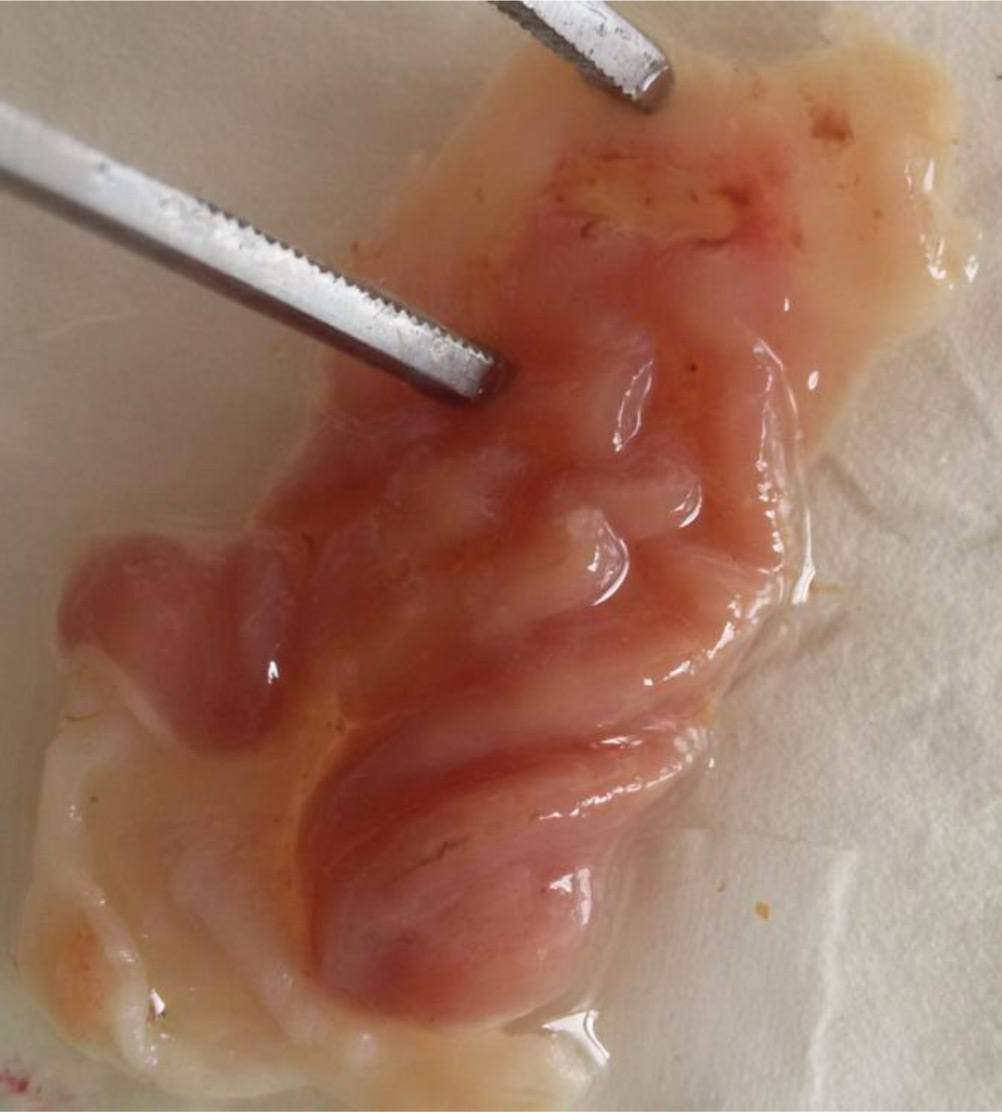 Рис. 3. Гистологическая картина СОЖ крысы на фоне приема диклофенака. Окраска гематоксилин-эозин, Ув. × 40. Видна глубокая эрозия СОЖ, уменьшение плотности желез, инфильтрация мышечной пластинки. 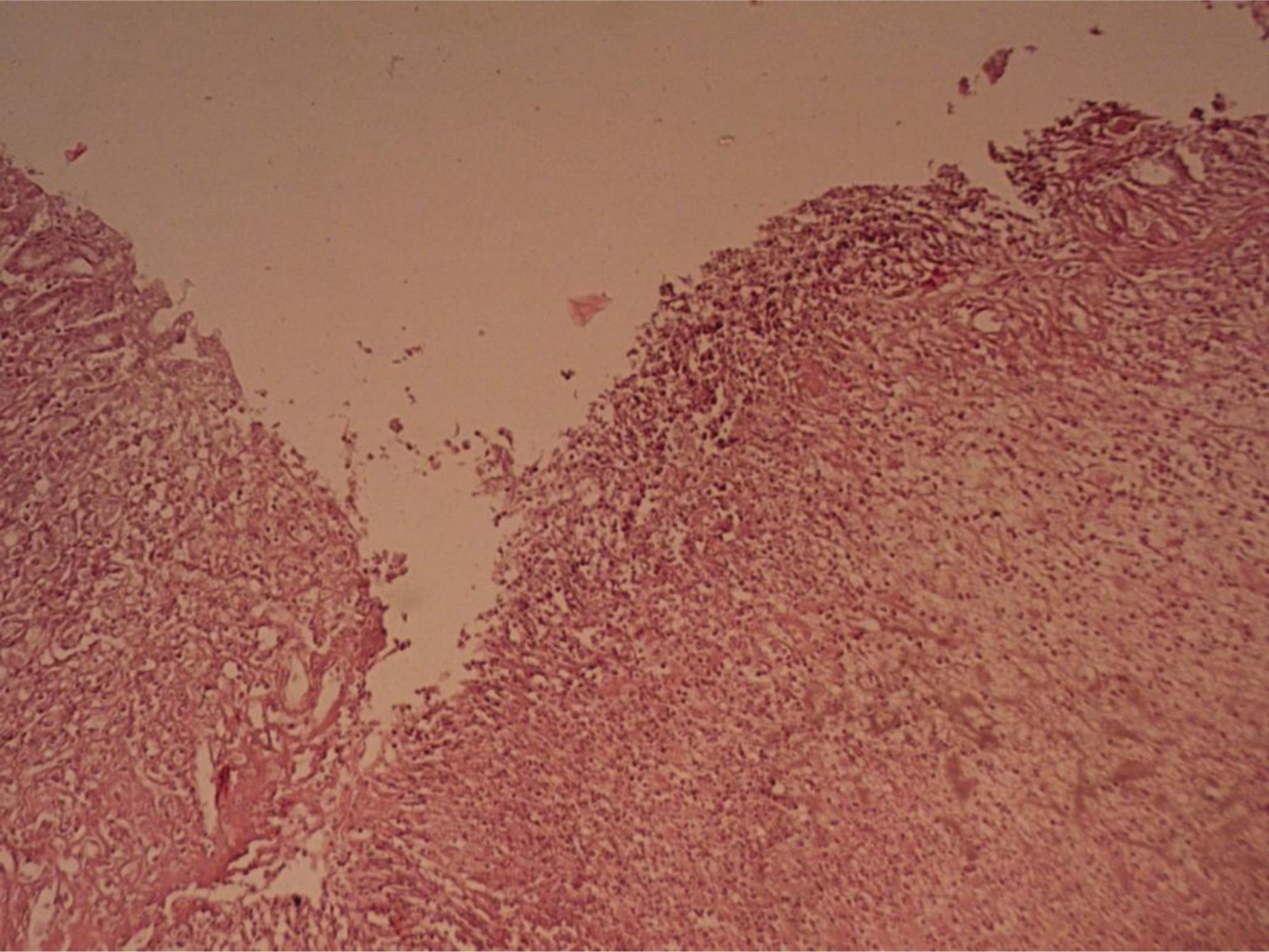 Выводы АМГ показал выраженную специфическую достоверную анальгетическую и противовоспалительную активность в экспериментах на животных. При субхроническом введении в дозах среднеэффективных по противовоспалительному каррагениновому тесту АМГ вызывал лишь единичные и неглубокие эрозии только у 1/3 животных, чем показал существенно меньшее ульцерогенное действие по сравнению с широко применяемым неселективным ЦОГ-блокатором диклофенаком. Немногочисленность сообщений о безопасности АМГ, небольшой опыт его применения, а также факт образования из него в системном кровотоке высоко ульцерогенного толметина, диктует необходимость дальнейших исследований, более тщательного изучения возможных побочных эффектов нового препарата амтолметин гуацила. Список литературы 1. Аргунова И.А. Сплав коморбидности и полипрагмазии как риск ульцерогенеза. Возможности прогнозирования и профилактики симптоматических гастродуоденальных язв. Поликлиника 2016; (4-3): 44-49. 2. Вялов С.С. Противовоспалительная терапия и гастротоксичность: реальные возможности профилактики. РМЖ; 2014 (22): 1644-1649. 3. Гайдукова И.З., Ребров А.П., Хондкарян Э.В., Апаркина А.В. Эффективность и кардиоваскулярная безопасность амтолметин гуацила в лечении больных анкилозирующим спондилитом (болезнь Бехтерева): Окончательные результаты исследования КОРОНА. Фарматека 2016; 7 (320): 53-58. 4. Гайдукова И.З., Хапаркина А.В., Ребров А.П. Изменение концентрации молекул адгезии и фактора роста эндотелия сосудов в сыворотке крови при применении амтолметина гуацила у пациентов с активным анкилозирующим спондилитом: результаты 56-недельного проспективного открытого контролируемого наблюдения. Терапевтический архив 2017; 89 (5): 38-45. 5. Гайдукова И.З., Хондкарян Э.В., Апаркина А.В., Ребров А.П. Сравнительная эффективность и безопасность трех режимов назначения нестероидных противовоспалительных препаратов для лечения хронической боли в спине. Фарматека 2017; 7 (340): 34-39. 6. Денисов Л.Н., Цветкова Е.С., Оттева Э.Н., Дубиков А.Н., Якупова С.П., Иванова О.Н., Коршунов Н.И., Вайсберг А.Р., Абышев Р.А., Тартынов А.В., Насонов Е.Л. Эффективность и безопасность амтолметин гуацила в терапии остеоартрита и ассоциированной диспепсии в рутинной клинической практике – "АГАТА". Медицинский совет 2018; (9): 56-60. 7. Бузлама А.В. и др. Доклинические исследования лекарственных веществ: учебное пособие; под ред. А.А. Свистунова. М.: ГЭОТАР-Медиа, 2017. 384 с. 8. Дроздов В.Н. НПВП с собственным механизмом защиты желудка – реально ли это? РМЖ 2013; (30): 1596-1599. 9. Елисеев М.С., Желябина О.В. Сочетание подагры и болезни депонирования пирофосфатов кальция: трудности диагностики и лечения. РМЖ Медицинское обозрение 2017; (1): 44-47. 10. Каратеев А.Е. Амтолметин гуацил: можно ли создать "улучшенный" НПВП? Медицинский Совет. Ревматология 2013; (12): 84-89. 11. Каратеев А.Е. Модификация традиционных НПВП как метод повышения их безопасности и удобства применения. РМЖ 2015; (7): 392-396. 12. Колоколов О.В., Колоколова А.М. Боль в спине у пациентов с коморбидной патологией: как выбрать нестероидный противовоспалительный препарат. РМЖ 2016; 24 (25): 1718-1723. 13. Коруцци Г., Бертачини Дж. Воздействие на желудок нового нестероидного противовоспалительного лекарственного препарата амтолметин гуацила. РМЖ 2013; (34): 1758-1764. 14. Лапина Т.Л. Пути снижения гастроинтестинального риска при назначении нестероидных противовоспалительных препаратов. Неврология и ревматология Приложение Consilium medicum 2013; (2): 9-11. 15. Максимов М.Л. Возможности снижения риска желудочно-кишечных осложнений при лечении современными нестероидными противовоспалительными препаратами. РМЖ 2016; 24 (24): 1643-1649. 16. Пасечников В.Д. Механизмы защиты слизистой оболочки желудка и NO-высвобождающие нестероидные противовоспалительные препараты. Consilium medicum 2013; 15 (9): 76-80. 17. Руководство по проведению доклинических исследований лекарственных средств. Под ред. А.Н. Миронова. М.: Гриф и К, 2012. 944 с. 18. Тавелла А., Урсини Дж. Клиническое исследование противовоспалительной активности и переносимости со стороны желудочно-кишечного тракта Амтолметина гуацила (нового НПВП) по сравнению с диклофенаком у пациентов пожилого возраста с патологиями костно-суставной системы. РМЖ 2013; (32): 1678-1682. 19. Трухан Д.И. Деговцев Е.Н. Выбор НПВС для пациента с хроническим послеоперационным болевым синдромом на амбулаторно-поликлиническом этапе: в фокусе – амтолметин гуацил. Стационарозамещающие технологии: Амбулаторная хирургия 2016; (1-2): 88-93. 20. Цветкова Е.С., Денисов Л.Н., Оттева Э.Н., Дубиков А.Н., Якупова С.П., Иванова О.Н., Коршунов Н.И., Вайсберг А.Р., Абышев Р.А., Тартынов А.В., Насонов Е.Л. Открытое многоцентровое наблюдательное исследование эффективности, переносимости и безопасности нестероидного противовоспалительного препарата амтолметин гуацила у пациентов с остеоартритом коленных суставов и диспепсией. Научно-практическая ревматология 2016; 54 (6): 654-659. 21. Циммерман Я.С. Поражение желудка, индуцированное приемом нестероидных противовоспалительных препаратов (НПВП): НПВП-гастрит или НПВП-гастропатия? Клиническая фармакология и терапия 2018; 27 (1): 14-21. 22. Цуканов В., Васютин А., Тонких Ю., Перетятько О. Распространенность и факторы риска язвенной болезни. Врач 2018; 29 (12): 63-65.
Corresponding Author: Tatiana Michaylovna Konshina; e-mail: tmkpharm@mail.ru. Conflict of interest. None declared. Funding. The study had no sponsorship. Abstract The most important problem of non-steroid anti-inflammatory drugs (NSAIDs) is a high risk of ulcerogenicity. It is possible to reduce it by the increase in gastric mucosa concentrations of gastroprotective NO. New NSAIDs Amtolmetin guacil (AMG) was registered in Russia in 2013. It is positioned as an effective medicine with gastroprotective action. AMG stimulates capsaicinoid receptors and accumulates NO in the stomach. However, the data on the effectiveness and safety of AMG are few. During its metabolism highly ulcerogenic Tolmetin is formed. The purpose of our research was to study the anti-inflammatory, analgesic and ulcerogenic effect of AMG after intragastric administration. The research was carried out on white nonlinear mice and rats of both sexes. Our study showed that AMG effectively reduced the severity of carrageenan edema of the rat's paw and reduced the number of acetic cramps in mice. Gastric mucosa of most animals was without pathological changes, single shallow erosions without infiltration were found in 32% of animals after administration during 4 days of AMG to rats at a dose of 200 mg/kg once a day. Diclofenac in the same conditions at a dose of 10 mg/kg caused deep defects in 75% of rats. AMG showed pronounced analgesic and anti-inflammatory effect. Our results also confirmed the advantage of AMG compared to diclofenac in its effect on the gastric mucosa. Key words non-steroidal anti-inflammatory drugs, amtolmetin guacil, ulcerogenicity, gastrotoxicity, diclofenac References 1. Argunova I.A. Splav komorbidnosti i polipragmazii kak risk ul'cerogeneza. Vozmozhnosti prognozirovaniya i profilaktiki simptomaticheskih gastroduodenal'nyh yazv. [Comorbidity plus polypharmacy as risk of ulcerogenesis. Possibilities for prediction and prevention of symptomatic gastroduodenal ulcers]. Poliklinika [Polyclinic] 2016; (4-3): 44-49. (In Russ.) 2. Vyalov S.S. Protivovospalitel'naya terapiya i gastrotoksichnost': real'nye vozmozhnosti profilaktiki. [Anti-Inflammatory therapy and gastrotoxicity: real possibilities of prevention]. RMZH [RMJ] 2014; (22):1644-1649. (In Russ.) 3. Gajdukova I.Z., Rebrov A.P., Hondkaryan H.V., Aparkina A.V. Effektivnost' i kardiovaskulyarnaya bezopasnost' amtolmetinguacila v lechenii bol'nyh ankiloziruyushchim spondilitom (bolezn' Bekhtereva): Okonchatel'nye rezul'taty issledovaniya CORONA. [Efficacy and cardiovascular safety of amtolmetin guacil in the treatment of patients with ankylosing spondylitis: final results of CORONA study]. Farmateka [Pharmateca] 2016; 7 (320): 53-58. (In Russ.) 4. Gajdukova I.Z., Haparkina A.V., Rebrov A.P. Izmenenie koncentracii molekul adgezii i faktora rosta ehndoteliya sosudov v syvorotke krovi pri primenenii amtolmetinaguacila u pacientov s aktivnym ankiloziruyushchim spondilitom: rezul'taty 56-nedel'nogo prospektivnogo otkrytogo kontroliruemogo nablyudeniya. [Changes in the concentration of adhesion molecules and vascular endothelial growth factor in blood serum in patients with active ankylosing spondylitis using amtolmetinguacil: results of 56-week prospective open controlled follow-up]. Terapevticheskij arhiv [Therapeutic archive] 2017; 89 (5): 38-45. (In Russ.) 5. Gajdukova I.Z., Hondkaryan Eh.V., Aparkina A.V., Rebrov A.P. Sravnitel'naya ehffektivnost' i bezopasnost' trekh rezhimov naznacheniya nesteroidnyh protivovospalitel'nyh preparatov dlya lecheniya hronicheskoj boli v spine. [Comparative efficacy and safety of three modes for use of nonsteroid anti-inflammatory drugs for the treatment of chronic back pain]. Farmateka [Pharmateca] 2017; 7 (340): 34-39. (In Russ.) 6. Denisov L.N., Cvetkova E.S., Otteva Eh.N., Dubikov A.N., Yakupova S.P., Ivanova O.N., Korshunov N.I., Vajsberg A.R., Abyshev R.A., Tartynov A.V., Nasonov E.L. Ehffektivnost' i bezopasnost' amtolmetinaguacila v terapii osteoartrita i associirovannoj dispepsii v rutinnoj klinicheskoj praktike – "AGATA".[Efficacy and safety of amtolmetin guacil in the therapy of osteoarthritis and associated dyspepsia in routine clinical practice – AGATA]. Medicinskij sovet [Medical Council] 2018;(9): 56-60. doi: 10.21518/2079-701X-2018-9-56-60. (In Russ.) 7. Buzlama A.V Doklinicheskie issledovaniya lekarstvennyh veshchestv: uchebnoe posobie. [Preclinical studies of drugs: textbook]. Edited by Svistunov A.A. Moscow: GEHOTAR-Media, 2017. (In Russ.) 8. Drozdov V.N. NPVP s sobstvennym mekhanizmom zashchity zheludka – real'no li ehto? [NSAIDs with their own mechanism of protection of the stomach – is it real?]. RMZH [RMJ] 2013; (30): 1596-1599. (In Russ.) 9. Eliseev M.S., Zhelyabina O.V. Sochetanie podagry i bolezni deponirovaniya pirofosfatov kal'ciya: trudnosti diagnostiki i lecheniya. [The combination of gout and calcium pyrophosphate deposition disease: the difficulties of diagnosis and treatment]. RMZH. Medicinskoe obozrenie [RMJ. Medical Review] 2017; (1): 44-47. (In Russ.) 10. Karateev A.E. Amtolmetinguacil: mozhno li sozdat' "uluchshennyj" NPVP? [Amtolmetin guacil: is it possible to develop an "advanced" NSAID?]. Meditsinskiy Sovet. Revmatologiya [Medical Council. Rheumatology] 2013; (12): 84-89. doi: 10.21518/2079-701X-2013-12-84-89. (In Russ.) 11. Karateev A.E. Modifikaciya tradicionnyh NPVPkak metod povysheniya ih bezopasnosti i udobstva primeneniya. [Modification of traditional NSAIDs as a method of improving their safety and ease of use]. RMZH [RMJ] 2015; (7): 392-396. (In Russ.) 12. Kolokolov O.V., Kolokolova A.M. Bol' v spine u pacientov s komorbidnoj patologiej: kak vybrat' nesteroidnyj protivovospalitel'nyj preparat. [Back pain in comorbid patients: the choice of non-steroidal anti-inflammatory drug]. RMZH [RMJ] 2016; (25):1718-1723. (In Russ.) 13. Korucci G., Bertachini D. Vozdejstvie na zheludok novogo nesteroidnogo protivovospalitel'nogo lekarstvennogo preparata amtolmetinguacila. [The effect of the new non-steroidal anti-inflammatory drug amtolmetin guacil on the stomach]. RMZH [RMJ] 2013; (34): 1758-1764. (In Russ.) 14. Lapina T.L. Puti snizheniya gastrointestinal'nogo riska pri naznachenii nesteroidnyh protivovospalitel'nyh preparatov. [Ways to reduce gastrointestinal risk in the appointment of non-steroidal anti-inflammatory drugs]. Nevrologiya i revmatologiya. Prilozhenie Consilium medicum. [Neurology and rheumatology. Supplement to Consilium Medicum] 2013; (2): 9-11 (In Russ.) 15. Maksimov M.L. Vozmozhnosti snizheniya riska zheludochno-kishechnyh oslozhnenij pri lechenii sovremennymi nesteroidnymi protivovospalitel'nymi preparatami. [Possibilities for risk reduction of gastrointestinal complications in the course of the treatment with modern non-steroidal anti-inflammatory drugs]. RMZH [RMJ] 2016; (24):1643-1649. (In Russ.) 16. Pasechnikov V.D. Mekhanizmy zashchity slizistoj obolochki zheludka i NO-vysvobozhdayushchie nesteroidnye protivovospalitel'nye preparaty. [Mechanisms of protection of gastric mucosa and NO-releasing nonsteroidal anti-inflammatory drugs]. Consilium medicum 2013; 15 (9): 76-80. (In Russ.) 17. Rukovodstvo po provedeniyu doklinicheskih issledovanij lekarstvennyh sredstv. [Guidelines for Pre-clinical Trials of Drugs.] Edited by Mironov A.N. Moscow: Grif i K, 2012. (In Russ.) 18. Tavella A., Ursini D. Klinicheskoe issledovanie protivovospalitel'noj aktivnosti i perenosimosti so storony zheludochno-kishechnogo trakta Amtolmetinaguacila (novogo NPVP) po sravneniyu s diklofenakom u pacientov pozhilogo vozrasta s patologiyami kostno-sustavnoj sistemy. [Clinical study anti-inflammatory activity and tolerability from the gastrointestinal tract of Amtolmetinaguacil (a new NSAID) compared with Diclofenac in patients of advanced age with the pathologies of the osteoarticular system]. RMZH [RMJ] 2013; (32): 1678-1682. (In Russ.) 19. Trukhan D.I., Degovtsov E.N., Vybor NPVS dlya pacienta s hronicheskim posleoperacionnym bolevym sindromom na ambulatorno-poliklinicheskom ehtape: v fokuse – amtolmetinguacil. [Choice of NSAIDs for patients with chronic post-surgical pain on an outpatient-polyclinic stage: focus on amtolmetin guacil]. Stacionarozameshchayushchie tekhnologii: Ambulatornaya hirurgiya: [Ambulatory surgery: hospital-replacing technologies] 2016; (1-2): 88-93. (In Russ.) 20. Cvetkova E.S., Denisov L.N., Otteva Eh.N., Dubikov A.N., Yakupova S.P., Ivanova O.N., Korshunov N.I., Vajsberg A.R., Abyshev R.A., Tartynov A.V., Nasonov E.L. Otkrytoe mnogocentrovoe nablyudatel'noe issledovanie ehffektivnosti, perenosimosti i bezopasnosti nesteroidnogo protivovospalitel'nogo preparata amtolmetinaguacila u pacientov s osteoartritom kolennyh sustavov i dispepsiej. [An open-label multicenter observational study of the efficacy, tolerability, and safety of the nonsteroidal anti-inflammatory drug amtolmetin guacil in patients with knee osteoarthritis and dyspepsia]. Nauchno-prakticheskaya revmatologiya [Rheumatology Science and Practice] 2016; 54 (6): 654-659. (In Russ.) 21. Cimmerman Ya.S. Porazhenie zheludka, inducirovannoe priemom nesteroidnyh protivovospalitel'nyh preparatov (NPVP): NPVP-gastrit ili NPVP-gastropatiya? [Stomach damage induced by nonsteroidal anti-inflammatory drugs (NSAIDs): NSAIDs-gastritis or NSAIDs-gastropathy?]. Klinicheskaya farmakologiya i terapiya [Clinical pharmacology and therapy] 2018, 27 (1): 14-21. (In Russ.) 22. Cukanov V., Vasyutin A., Tonkih Yu., Peretyat'ko O. Rasprostranennost' i faktory riska yazvennoj bolezni. [The prevalence and risk factors of peptic ulcer disease] Vrach 2018; 29 (12): 63-65. doi: 10.29296/25877305-2018-12-15. (In Russ.) |
[ См. также ] Рубрики |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|