| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Стабильность параметров гемоцитометрии при различных условиях хранения образцов
Автор для корреспонденции: Шульга Александр Сергеевич; e-mail: contrarius@yandex.ru. Финансирование. Исследование не имело спонсорской поддержки. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Аннотация Стабильность образцов необходима для получения надежных результатов в практике клинической лаборатории. Цель работы – исследовать изменение значений гематологических показателей в образцах, хранившихся до 72 часов при различных температурных режимах. Всего было проанализировано 60 образцов цельной крови, хранившихся в разных условиях: при комнатной температуре (25°C), нагревании до 35°C и охлаждении до 4°C в различные временные точки: сразу после забора крови и далее последовательно через 3, 6, 12, 24, 48 и 72 часа. Использовались пробирки с антикоагулянтом K2EDTA, результаты получены с применением гематологического анализатора UniCel DxH 800. Медианное смещение параметров относительно исходного уровня для каждой комбинации времени и температуры оценивалось с помощью теста совпадающих пар Уилкоксона. Сдвиг значений показателей гемограммы, полученный с использованием графиков Бланда-Альтмана, сравнивался с максимально допустимой погрешностью, указанной в спецификации качества для желательной погрешности. Гемоглобин, количество эритроцитов, среднее содержание гемоглобина в эритроцитах и содержание тромбоцитов были стабильны в течение как минимум 72 часов при всех примененных в эксперименте температурных режимах. Для остальных тестируемых параметров первые неприемлемые изменения значений показателей гемограммы наблюдались уже через 3 часа при хранении образцов при 25°C и 35°C. В охлажденных до 4°C пробах первые статистически значимые различия были зафиксированы через 6 часов. В итоге, хранение образцов в течение 72 часов при комнатной температуре привело к достоверным неприемлемым изменениям 6 параметров гемограммы из 11 исследованных, при 4°C недопустимо изменились 5 параметров, а при 35°C – 7 параметров. Полученные результаты, с одной стороны, свидетельствуют о том, что при анализе результатов гематологических тестов, проведенных с задержкой после забора образца, следует учитывать изменения гематологических параметров; с другой же стороны, дают сведения о списке параметров, подверженных температурно-временным изменениям, а также об интенсивности этих изменений. Ключевые слова стабильность образцов, условия хранения, гематологические исследования, гематологические анализаторы doi: 10.29234/2308-9113-2021-9-3-54-74 Для цитирования: Шульга А. С., Крайнова Н. Н., Бурцев Д. В. Стабильность параметров гемоцитометрии при различных условиях хранения образцов. Медицина 2021; 9(3): 54-74 Введение В настоящее время в мировой практике организации лабораторной медицины одним из самых значимых трендов является централизация лабораторных исследований. При этом возможно существенное повышение качества оказания медицинской помощи пациентам в соответствии с самими строгими требованиями актуальных международных клинических стандартов [1,2]. К очевидным положительным следствиям централизации лабораторий относятся: интенсификация внедрения в лабораторную практику высокоинформативных технологий, значительно повышающих клиническую значимость анализов и уменьшающих сроки их выполнения [3], экономическая выгода, существенное расширение спектра оказываемых лабораторных услуг, упрощение механизмов внесения корректив в технологии централизованных процессов [1,4]. Вместе с тем при укрупнении централизованного лабораторного подразделения неизбежно возникает ряд проблем, и одна из наиболее важных из них – несоответствие имеющихся условий транспортировки и хранения образцов установленным стандартам и правилам [5]. Связано это несоответствие прежде всего с удаленным расположением подконтрольных территорий, что приводит зачастую к несвоевременной доставке проб и их накапливанию, а в результате – к недостоверным результатам, не отражающим реального клинического состояния пациента. Это согласуется также с утверждением, что около 70% всех лабораторных ошибок при анализе образцов биоматериала приходится именно на преаналитическую стадию [6]. Клинический анализ крови (CBC, complete blood count) является важным тестом для диагностики и мониторинга широчайшего спектра заболеваний – но при условии, что качество в течение всего процесса анализа можно гарантировать. На тему стабильности проб крови для выполнения CBC опубликован целый ряд статей, но приводимые в них результаты зачастую противоречивы и в значительной степени зависят от используемых геманализаторов [7-14]. Материал и методы исследования В данном исследовании использовались образцы цельной крови от 20 амбулаторных пациентов без известных сопутствующих заболеваний и не получавшие антиагрегантную или антикоагулянтную терапию на момент забора крови. От каждого донора были собраны в пробирки с K2EDTA 3 образца объемом по 6 мл (т. е. всего – 60 пробирок), и для каждой из этих пробирок в течение 30 минут после сбора были выполнены 3 исходных (базовых) измерения на гематологическом анализаторе UniCel DxH 800 Coulter Cellular Analysis System (Beckman Coulter Inc., USA, Miami, FL). Инструкции, взятые из руководства по эксплуатации анализатора, строго соблюдались. Исследовались изменения следующих параметров клинического анализа крови (CBC): количество лейкоцитов (WBC), количество эритроцитов (RBC), концентрация гемоглобина (HGB), гематокрит (HCT), средний корпускулярный объем (MCV), среднее количество корпускулярного гемоглобина (MCH), средняя корпускулярная концентрация гемоглобина (MCHC), два показателя ширины распределения эритроцитов – RDW (RDW-CV) и RDW-SD, количество тромбоцитов (PLT), средний объем тромбоцитов (MPV). Для каждого из этих параметров было рассчитано среднее значение по 9 исходным измерениям; эти средние значения были приняты в качестве исходных (базовых). После определения исходных значений образцы подлежали хранению: из трех образцов, взятых от каждого из 20 доноров, один хранился при комнатной температуре (25°C), второй – в условиях охлаждения (в холодильнике при 4°C), третий – в условиях нагревания (в термостате при 35°C). Образцы анализировались после 3, 6, 12, 24, 48 и 72 часов хранения – в каждой из этих временных точек для каждого из 20 образцов проводились на гематологическом анализаторе 3 измерения интересующих параметров CBC, после чего пробирки вновь хранились при указанных температурах. По этим 3 измерениям рассчитывалось среднее значение каждого параметра CBC, которое принималось как репрезентативное для данного образца и данных значений времени и температуры хранения. Различия между образцами оценивались с помощью теста совпадающих пар Уилкоксона, p-значения меньше 0,05 считались статистически значимыми. Отклонения от исходного значения в образцах со статистически значимыми различиями затем анализировались с помощью графиков Бланда-Альтмана и сравнивались с текущими спецификациями качества для желательной погрешности (desirable bias), полученной на основе внутрииндивидуальных и межиндивидуальных отклонений [15]. Изменение или сдвиг, превышающие максимально допустимую погрешность, рассматривались как признак неприемлемой погрешности. Удовлетворительные результаты внутрилабораторного контроля качества в оценке работы геманализатора были получены на протяжении всего исследования. Температура хранения образцов контролировалась и поддерживалась в заданных пределах на протяжении всего эксперимента. Результаты В 1-й временной точке, спустя 3 ч. с момента получения исходных значений параметров CBC, проверка статистической значимости различий показателей показала: в охлажденных образцах (4°C) статистически значимых изменений не было, в образцах при комнатной температуре (25°C) – достоверные изменения MCHC и RDW, в нагретых образцах (35°C) – MCHC, RDW и RDW-SD (рис. 1, табл. 1-3). Рис. 1. (A-K) Сравнение результатов медианных значений между исходным образцом (0 ч.) и различными сроками хранения 3, 6, 12, 24, 48 и 72 ч. при различных режимах хранения: комнатная температура (25°C), нагревание до 35°C и охлаждение до температуры 4°C. 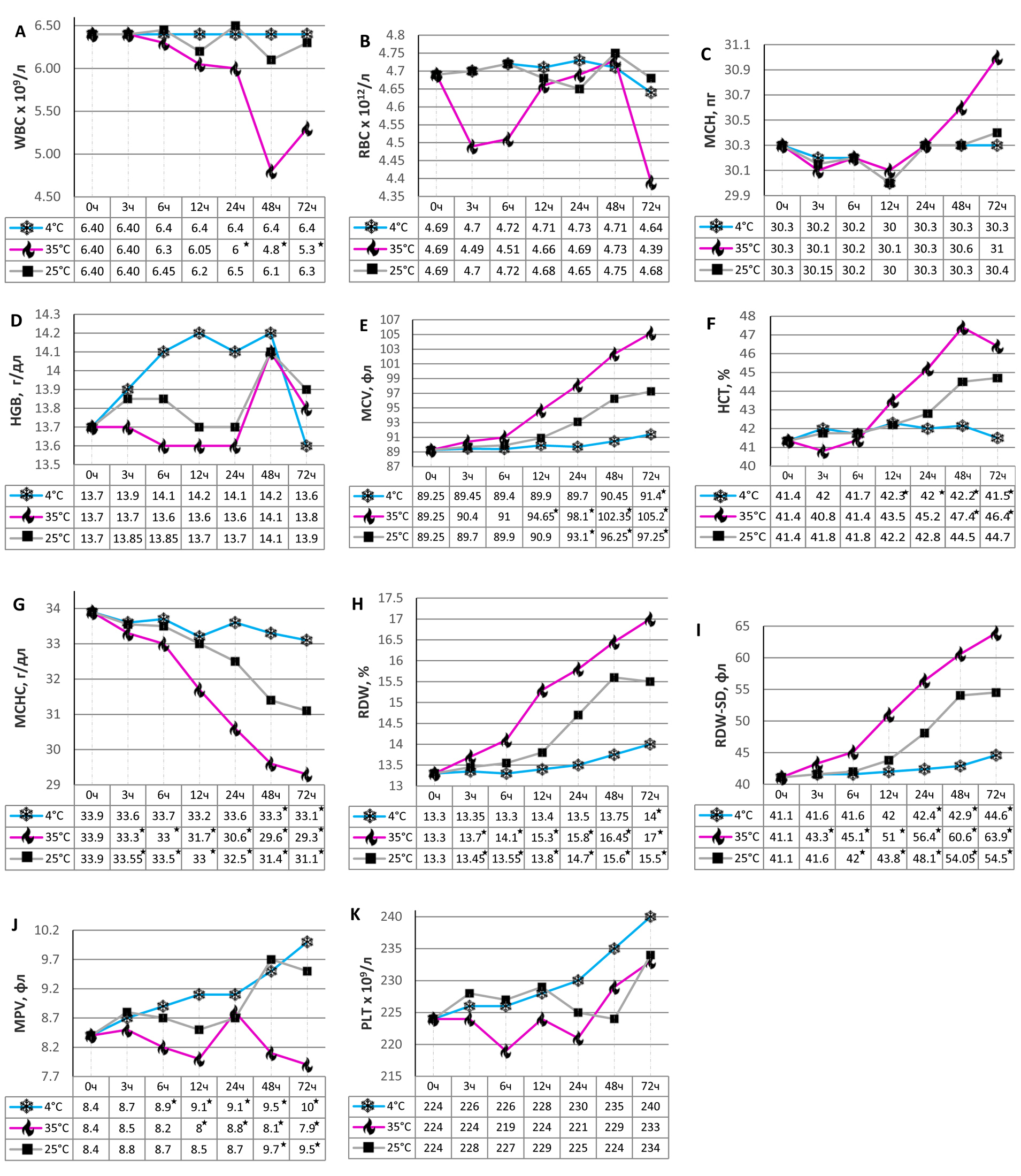 * – статистически значимая разница, p<0,05 (тест совпадающих пар Уилкоксона). Через 6 ч. в охлажденных образцах статистически значимый сдвиг был зарегистрирован лишь для показателя MPV, в то время как для образцов при комнатной температуре к MCHC и RDW добавился параметр RDW-SD, а для нагретых остались те же изменения, что и ранее – MCHC, RDW и RDW-SD (рис. 1, табл. 1-3). Через 12 ч. от начала эксперимента в охлажденных образцах была определена достоверная разница значений опять-таки только для MPV, при комнатной температуре набор параметров с изменениями сохранился – MCHC, RDW и RDW-SD, а в образцах из термостата к MCHC, RDW, RDW-SD добавились параметры HCT, MCV и MPV (рис. 1, табл. 1-3). После 24 ч. хранения при температуре 4°C статистически значимая разница была получена, помимо MPV, и для RDW-SD; при комнатной температуре список из MCHC, RDW и RDW-SD дополнился параметром MCV, а при 35°C – к MCHC, RDW, RDW-SD, HCT, MCV и MPV добавился параметр WBC (рис. 1, табл. 1-3). Через двое суток (48 ч.) от начала исследования для проб при 4°C к RDW-SD и MPV добавился MCHC, при 25°C список из MCHC, RDW, RDW-SD и MCV стал включать еще и параметры MPV и HCT, при 35°C параметры с изменениями – те же: MCHC, RDW, RDW-SD, HCT, MCV, MPV и WBC (рис. 1, табл. 1-3). В последней временной точке, 72 ч., в образцах при 4°C достоверно измененные показатели – MPV, RDW-SD, MCHC, MCV и RDW, при 25°C и 35°C те же, что и при хранении 48 ч. (рис. 1, табл. 1-3). Таблица 1. Медианные значения и статистическая значимость изменений параметров клинического анализа крови при температуре хранения 25°C ((Медиана; межквартильный интервал; 95% доверительный интервал для медианы; p в сравнении с исходным образцом (0 ч))
Примечание. Статистическая значимость изменений p <0,05, тест совпадающих пар Уилкоксона. Полужирным курсивом выделена статистически значимая разница. Таблица 2. Медианные значения и статистическая значимость изменений параметров клинического анализа крови при температуре хранения 4°C (Медиана; межквартильный интервал; 95% доверительный интервал для медианы; p в сравнении с исходным образцом (0 ч))
Примечание. Статистическая значимость изменений p <0,05, тест совпадающих пар Уилкоксона. Полужирным курсивом выделена статистически значимая разница. Таблица 3. Медианные значения и статистическая значимость изменений параметров клинического анализа крови при температуре хранения 35°C (Медиана; межквартильный интервал; 95% доверительный интервал для медианы; p в сравнении с исходным образцом (0 ч))
Примечание. Статистическая значимость изменений p <0,05, тест совпадающих пар Уилкоксона. Полужирным курсивом выделена статистически значимая разница. Следующим этапом исследования являлся анализ графиков Бланда-Альтмана (табл. 4-6) на предмет сравнения выявленных в нашей работе смещений средних значений показателей (bias) с текущими спецификациями качества (desirable quality specifications for bias) [15], указанными в табл. 4-6 как BIASмакс. Во временных точках 3 ч. и 6 ч. значимые смещения параметров зарегистрированы не были, за исключением MCHC в образцах при 35°C. Спустя 12 ч. смещение, превышающее текущие спецификации качества, наблюдалось в образцах при комнатной температуре (25°C) для MCHC, а в образцах при 35°C – для HCT, MCV, MCHC и RDW. Через 24 ч. картина для образцов при 35°C не изменилась, а в образцах при комнатной температуре к MCHC добавилось смещение для MCV. Спустя 48 и 72 ч. смещение выше текущих спецификаций качества было получено в образцах при 25°C для HCT, MCV, MCHC и RDW, при 4°C – для MCHC и PLT, при 35°C – для HCT, MCV, MCHC и RDW. Таблица 4. Среднее процентное смещение для параметров клинического анализа крови при комнатной температуре хранения (25°C) (в сравнении с исходным образцом (0 ч); % смещения; интервал 95% ДИС для образцов при времени хранения)
Примечание. Bias макс. – желательная погрешность (desirable bias). 95% ДИС – доверительный интервал пределов согласия. * – медианное смещение параметров относительно исходного уровня для данной комбинации времени и температуры превышает желаемые спецификации качества (Bias макс.). Полужирным курсивом выделена статистически значимая разница, p<0,05 (тест совпадающих пар Уилкоксона). Таблица 5. Среднее процентное смещение для параметров клинического анализа крови при температуре хранения 4°C (в сравнении с исходным образцом (0 ч); % смещения; интервал 95% ДИС для образцов при времени хранения)
Примечание. Bias макс. – желательная погрешность (desirable bias). 95% ДИС – доверительный интервал пределов согласия. * – медианное смещение параметров относительно исходного уровня для данной комбинации времени и температуры превышает желаемые спецификации качества (Bias макс.). Полужирным курсивом выделена статистически значимая разница, p<0,05 (тест совпадающих пар Уилкоксона). Таблица 6. Среднее процентное смещение для параметров клинического анализа крови при температуре хранения 35° C (в сравнении с исходным образцом (0 ч.); % смещения; интервал 95% ДИС для образцов при времени хранения)
Примечание. Bias макс. – желательная погрешность (desirable bias). 95% ДИС – доверительный интервал пределов согласия. * – медианное смещение параметров относительно исходного уровня для данной комбинации времени и температуры превышает желаемые спецификации качества (Bias макс.). Полужирным курсивом выделена статистически значимая разница, p<0,05 (тест совпадающих пар Уилкоксона). Обсуждение результатов Крайне важным аспектом для поддержания высокого качества выполнения лабораторных исследований является знание о стабильности тестируемых показателей. На сегодняшний день опубликованы исследования надежности отсроченного гематологического анализа образцов цельной крови с ЭДТА в качестве антикоагулянта на широком спектре гематологических анализаторов [7-14]. Нами было обнаружено пять исследований на предмет аналитической стабильности гематологических параметров в зависимости от условий хранения образцов с использованием анализаторов компании Beckman Coulter [16-20]. Ни в одном из них не сообщалось о стабильности показателей CBC при хранении проб выше 30°C. При этом следует отметить, что средние значения высоких температур, как минимум двух месяцев в году – июля и августа, в месте проведения данного эксперимента превышают 31°C. Согласно результатам нашего исследования содержание эритроцитов (RBC) и концентрация гемоглобина (HGB) оставались стабильными на протяжении как минимум 72 ч. независимо от выбора температурного режима хранения образцов. Поскольку среднее содержание гемоглобина в эритроците (MCH) является величиной, рассчитываемой через отношение концентрации гемоглобина (HGB) к количеству эритроцитов в литре крови (RBC), то стабильность этого эритроцитарного индекса четко объясняется полученными нами стабильными значениями концентрации гемоглобина и количества эритроцитов на протяжении 72 ч. хранения образцов при любом из примененных в данном исследовании температурных режимов. Наши результаты согласуются с выводами полученными авторами в отношении отсутствия достоверных изменений показателя MCH, RBC и HGB с использованием разных анализаторов: F. Imeri et al. в работе с Beckman Coulter LH 750 (Beckman Coulter, Miami, USA) [16], Joshi et al. при оценке стабильности проб на Sysmex XE-5000 (Sysmex, Kobe, Japan) [11] и исследование Oliveira L.R. et al. на ABX Pentra 60 (Horiba ABX Diagnostics, Montpellier, France) [14]. Анализ изменений другого эритроцитарного индекса – среднего корпускулярного объема эритроцита, MCV, выявил четкую закономерность в увеличении этого показателя с течением времени тем более, чем выше температура хранения. Так, стабильность MCV при комнатной температуре была гарантирована только в течение 12 ч., тогда как при 35°C – только 6 ч. Наши результаты отчасти согласуются с данными Bourner et al. о том, что MCV при комнатной температуре остается стабильным только в течение нескольких часов, независимо от анализатора [18]. Нами установлено, что наиболее длительно сохраняющаяся достоверность результатов измерения MCV определялась для образцов, которые хранились при 4°C – 48 ч. В схожем исследовании F. Imeri et al. установили, что стабильность MCV при 4°C составляла 10 ч. для Advia 120 (Bayer Diagnostics, Tarrytown, USA), 24 ч. для Sysmex XE-2100 (Sysmex, Kobe, Japan) и 48 ч. для LH 750 [16]. Гематологический параметр, связанный прямо пропорционально с величиной MCV – гематокрит (HCT), статистически значимо менялся вслед за увеличением среднего объема эритроцитов при хранении свыше 24 ч. при комнатной температуре, более 6 ч. при 35°C и оставался стабилен 72 ч. в условиях хранения образцов при 4°C. Несколько ранее опубликованных исследовательских работ подтверждают, что гарантировать сохранность значений гематокрита в течении 72 ч. может только охлаждение проб цельной крови до 4-8°C. Однако время хранения для поддержания стабильности гематокрита при 4°C у разных авторов различается: LH 750 и Sysmex XE-5000 до 72 часов, Sysmex XE 2100 до 48 часов и Advia 120 только до 24 часов [11, 16]. Средняя концентрация гемоглобина в клетке, MCHC, находясь в обратной зависимости от MCV, показала в нашем исследовании заметное снижение при температуре 22 C и 35 C уже через 3 ч. от момента забора крови в вакутейнеры. При 4°C MCHC демонстрировал среднее смещение менее максимально допустимого отклонения в течение не менее 24 ч. Отклонения в значениях таких параметров, как MCV, MCHC и HCT при хранении образцов цельной крови являются отражением процессов изменения морфологии эритроцитарной популяции с течением времени. Результаты исследовательской работы Arie Rahmnitarini et al. показали, что морфология эритроцитов начала меняться после 8 часов хранения при комнатной температуре [21]. Данный патофизиологический процесс зарубежными авторами обозначается как кренация эритроцитов и измеряется по шкале Turgeon [22]. Кренация эритроцитов, хранившихся при комнатной температуре, была более выраженной по сравнению с 4°C. Сфероциты были обнаружены при комнатной температуре после 16 часов хранения, а при температуре 4°C – после 24 ч. Морфологические изменения происходили в результате потери липидов мембраны эритроцитов и усиления её жесткости. Как следствие наблюдалось увеличение размера клеток с образованием сфероцитов и кренация. Кроме физических факторов, на функциональные и морфологические характеристики эритроцитов влияет также применение антикоагулянта в вакутейнерах для сбора образцов крови. Rodak et al. утверждают, что ЭДТА вызывает необратимые повреждения структурных элементов, биохимических процессов и функциональных свойств всех клеток крови [23], что, в том числе, приводит к кренации и формированию эхиноцитов. Rodak et al. указывает, что хранение образцов крови с ЭДТА в качестве антикоагулянта даже при температуре хранения 4-8°C в течение 72 часов вызывает морфологические изменения в эритроцитах и приводит к их чрезвычайной осмотической нестабильности. Изменение проницаемости цитоплазматической мембраны эритроцитов приводит к перераспределению моновалентных катионов натрия и калия между внутриклеточной и внеклеточной средой, с усилением поглощения молекул воды, что вызывает расширение клеток и увеличение их среднего объема (MCV) [24]. Отображением нарушения морфологии эритроцитов является также нарастание анизоцитоза в виде достоверного увеличения значений показателей RDW и RDW-SD, отмеченного в нашей работе. Разность в осмотической стабильности отдельных эритроцитов, связанная, вероятно, с возрастом клеток и наличием повреждений мембраны или внутриклеточных структур, тем более проявляется в условиях хранения образцов в пробирках с ЭДТА. RDW (%), показатель гетерогенности эритроцитов по объему, в нашем эксперименте достоверно увеличивался уже через три часа хранения крови при комнатной температуре или 35°C. В условиях хранения при 4°C RDW оказался стабилен на протяжении 48 ч. Подобным образом нами отмечены смещения выше допустимого порога и для RDW-SD. Аналогично, Oliveira L.R. et al. с использованием ABX Pentra 60 установили стабильность RDW только для образцов, хранившихся при 4°C до 48 часов [14]. Между тем, в том же исследовании при комнатной температуре RDW показал аналитическую неточность во все анализируемые периоды времени. Daves et al., анализируя пробы на Sysmex XN, продемонстрировали статистически значимые изменения RDW через 24 часа как для комнатного режима сохранения образцов, так и при 4°C [10]. Таким образом, в нашем эксперименте MCV, HCT, MCHC, RDW и RDW-SD оказались гематологическими параметрами весьма чувствительными к условиям хранения. Напротив, RBC, HGB и MCH продемонстрировали стабильность на протяжении всего исследования, длящегося 72 ч. Исходя из этого, можно заключить, что для образцов с отсроченным выполнением клинического анализа крови MCH, RBC и HGB должны рассматриваться как более достоверные показатели для интерпретации анемии вместо MCV, HCT, MCHC, RDW и RDW-SD. Существенные изменения морфологии эритроцитов, возникающие при хранении образцов цельной крови с ЭДТА, необходимо также учитывать при выполнении эритроцитометрии с построением кривой Прайс-Джонса. Данный анализ характеризует распределение эритроцитов по диаметру, являясь графическим отражением анизоцитоза. Можно утверждать, что высока вероятность получить недостоверные результаты эритроцитометрии с увеличением времени хранения проб крови. Что касается количества лейкоцитов (WBC), то при комнатной температуре и охлаждении образцов этот показатель незначительно и приемлемо изменялся до 72 ч. Для проб, хранившихся при 35°C, содержание лейкоцитов демонстрировало статистически значимое снижение медианы через сутки от начала эксперимента и дольше, хотя не превышало максимально допустимого смещения (bias) в 5,6% до семидесяти двух часов (табл. 6). Полученные в ходе нашей работы результаты согласуются с предыдущей оценкой изменчивости гематологических параметров при хранении проб, выполненной на нескольких гематологических анализаторах: Beckman Coulter LH 750, Bayer Advia 120, Sysmex XE 2100 и Sysmex XE-5000, когда авторы обнаружили, что количество лейкоцитов существенно не менялось в образцах, хранившихся при 4°C вплоть до 72 ч. [11,16]. Однако при комнатной температуре существует разница результатов: так, параметр WBC на Beckman Coulter LH 750 имел стабильность до 72 ч., на Advia 120 – 48 ч., на Sysmex XE 2100 – 24 ч., и Sysmex XE-5000 со стабильностью до 72 часов [11, 16]. В нашей работе при оценке изменчивости количества тромбоцитов на гематологическом анализаторе при хранении проб в любом из примененных температурных режимов не регистрировались статистически значимые сдвиги значений показателя PLT. Полученные нами результаты отличаются от заключений, приводимых в опубликованных ранее работах: параметр PLT был стабилен от 24 ч. (LH 750 и Advia 120) до 48 ч. (Sysmex XE 2100) при комнатной температуре [16]. Примечательно, что в этом же исследовании при изменении температуры хранения до 4°C стабильность не меняется строго в одном направлении: в охлажденных образцах стабильность PLT была либо ниже (Sysmex XE 2100; 4 ч.), либо равна (LH 750), либо выше (Advia 120; 72 ч.) значений, полученных при комнатной температуре. В совокупности эти результаты показывают, что не только время и температура хранения, но и принцип измерения влияют на стабильность образца. В другой работе, Oliveira L.R. et al. наблюдали неприемлемое процентное отличие от исходного уровня количества тромбоцитов с использованием анализатора ABX Pentra 60 как при комнатной температуре с 24 ч., так и при 4°C с 48 ч. [14]. MPV в нашей работе демонстрировал неприемлемое смещение результатов во всех трех режимах хранения: неожиданно раньше всего, с 6 ч. от начала эксперимента – при 4°C, в образцах, подвергавшихся нагреву с 12 ч. и с 48 ч. при комнатной температуре. Нестабильность MPV также наблюдалась в предыдущих исследованиях как при комнатной температуре, так и при 4°C и нагревании проб [12,14,16]. Поскольку в анализаторе UniCel DxH 800 MPV определяется непосредственно на основе анализа кривой распределения количества тромбоцитов, полученной методом импеданса, то возможным объяснением достоверного увеличения этого параметра при 4°C раньше, чем при комнатной температуре или даже нагревании до 35°C, может являться повреждение нормальной морфологии тромбоцитов при хранении, вызванное холодом. В условиях низких температур форма тромбоцитов меняется от дисковидной до сферической, с появлением игольчатых выступов на поверхности тромбоцитов [25]. Результаты настоящего исследования согласуются с предыдущими данными, демонстрирующими увеличение MPV при оценке импедансным методом как следствие повреждений при хранении [26]. Напротив, при оценке среднего объема тромбоцитов оптическим методом величина MPV снижается, вероятно, из-за разбавления цитоплазматического содержимого и, как результат – уменьшения коэффициента преломления [26]. Заключение Cогласно рекомендации ICSH [27], образцы крови должны обрабатываться через 4-8 часов после забора. Однако в повседневной практике централизованной клинической лаборатории периодически возникают ситуации, приводящие к отсроченному выполнению клинического анализа крови в связи с нарушением времени транспортировки, техническими неисправностями гематологического оборудования и другими причинами. Настоящее исследование демонстрирует важность знаний о надежности результатов измерений в пределах 72 часов хранения при разных условиях. Температура хранения при 35°C вызывала самые существенные изменения, как минимум, по семи протестированным параметрам. Следует учитывать данный аспект в странах с высокими температурами окружающей среды, что делает необходимым использование систем охлаждения для транспортировки образцов на большие расстояния. Таким образом, в результатах проб, измеренных с задержкой во времени, могут обнаруживаться изменения, не отражающие фактическое состояние здоровья человека. Это может приводить к затруднениям или даже ошибкам в принятии врачом клинического решения, поэтому, полагаем, что в отчете по результатам клинического анализа крови тех проб, которые доставлены в централизованную лабораторию с нарушением преаналитического этапа, может быть оставлен комментарий для курирующего врача с целью осторожной интерпретации результатов гемограммы. Список литературы 1. Кишкун А.А. Актуальность проблемы централизации клинических лабораторных исследований для системы здравоохранения страны. Лабораторная медицина 2011; (11): 29-34. 2. Кишкун А.А. Централизация лабораторных исследований как современная парадигма повышения экономической и клинической эффективности лабораторной диагностики. Клиническая лабораторная диагностика 2013; (9): 4. 3. Годков М.А. Принципы централизации лабораторных исследований. Лабораторная служба 2015; (4): 3-10. 4. Меньшиков В.В. Оптимизация расходов на здравоохранение, централизация лабораторных исследований и доступность лабораторной информации. Клиническая лабораторная диагностика 2014; (59): 4. 5. Гильманов А.А., Хайруллин И.И., Нурмыева Л.А. и др. Централизация лабораторной службы государственных медицинских учреждений города на базе клинико-диагностической лаборатории крупного многопрофильного стационара. Менеджер здравоохранения 2013; (11): 14-22. 6. Adcock Funk D.M., Lippi G., Favaloro E.J. et al. Quality standards for sample processing, transportation, and storage in hemostasis testing. Seminars in thrombosis and hemostasis 2012; 38(6): 576-585. doi: 10.1055/s-0032-1319768. 7. Lippi G., Guidi G.C., Mattiuzzi C. et al. Preanalytical variability: the dark side of the moon in laboratory testing. Clinical chemistry and laboratory medicine 2006; 44(4):358-365. doi: 10.1515/CCLM.2006.073. 8. Murray L.P., Baillargeon K.R., Bricknell J.R. et al. Determination of sample stability for whole blood parameters using formal experimental design. Analytical Methods 2019; 11(7): 930-935. doi: 10.1039/C8AY02351D. 9. Zini G. International Council for Standardization in Haematology (ICSH). Stability of complete blood count parameters with storage: toward defined specifications for different diagnostic applications. International journal of laboratory hematology 2014; 36(2): 111-113. doi: 10.1111/ijlh.12181. 10. Daves M., Zagler E.M., Cemin R. et al. Sample stability for complete blood cell count using the Sysmex XN haematological analyser. Blood transfusion = Trasfusione del sangue 2015; 13(4): 576-582. doi: 10.2450/2015.0007-15. 11. Joshi A., McVicker W., Segalla R. et al. Determining the stability of complete blood count parameters in stored blood samples using the SYSMEX XE-5000 automated haematology analyser. International journal of laboratory hematology 2015; 37(5): 705-714. doi: 10.1111/ijlh.12389. 12. Buoro S., Mecca T., Seghezzi M. et al. Assessment of blood sample stability for complete blood count using the Sysmex XN-9000 and Mindray BC-6800 analyzers. Revista brasileira de hematologia e hemoterapia 2016; 38(3): 225-239. doi: 10.1016/j.bjhh.2016.05.010. 13. Pintér E., László K., Schüszler I. et al. The stability of quantitative blood count parameters using the ADVIA 2120i hematology analyzer. Practical laboratory medicine 2015; 4: 16-21. doi: 10.1016/j.plabm.2015.12.001. 14. Oliveira L.R., Simionatto M., Cruz B.R. et al. Stability of complete blood count in different storage conditions using the ABX PENTRA 60 analyzer. International journal of laboratory hematology 2018; 40(3): 359-365. doi: 10.1111/ijlh.12797. 15. Ricós C., Alvarez V., Cava F. et al. Current databases on biological variation: pros, cons and progress. Scandinavian journal of clinical and laboratory investigation 1999; 59(7): 491-500. doi: 10.1080/00365519950185229. 16. Imeri F., Herklotz R., Risch L. et al. Stability of hematological analytes depends on the hematology analyser used: a stability study with Bayer Advia 120, Beckman Coulter LH 750 and Sysmex XE 2100. Clinica chimica acta; international journal of clinical chemistry 2008; 397(1-2): 68-71. doi: 10.1016/j.cca.2008.07.018. 17. Bruegel M., Nagel D., Funk M. et al. Comparison of five automated hematology analyzers in a university hospital setting: Abbott Cell-Dyn Sapphire, Beckman Coulter DxH 800, Siemens Advia 2120i, Sysmex XE-5000, and Sysmex XN-2000. Clinical chemistry and laboratory medicine 2015; 53(7): 1057-1071. doi: 10.1515/cclm-2014-0945. 18. Bourner G., Dhaliwal J., Sumner J. Performance evaluation of the latest fully automated hematology analyzers in a large, commercial laboratory setting: a 4-way, side-by-side study. Laboratory hematology: official publication of the International Society for Laboratory Hematology 2005; 11(4): 285-297. doi: 10.1532/lh96.05036. 19. Johnson M., Samuels C., Jozsa N. et al. Three-way evaluation of high-throughput hematology analyzers-Beckman Coulter LH 750, Abbott Cell-Dyn 4000, and Sysmex XE-2100. Laboratory Hematology 2002; 8: 230-238. 20. Vogelaar S.A., Posthuma D., Boomsma D. et al. Blood sample stability at room temperature for counting red and white blood cells and platelets. Vascular pharmacology 2002; 39(3): 123-125. doi: 10.1016/s1537-1891(02)00298-7. 21. Rahmanitarini A., Hernaningsih Y., Indrasari Y.N. et al. The stability of sample storage for complete blood count (CBC) toward the blood cell morphology. Bali Medical Journal 2019; 8(2): 391-395. doi: 10.15562/bmj.v8i2.1369. 22. Turgeon M.L. Basic Laboratory Assessment of Erythrocytes, Leukocytes, and Platelets. Clinical Hematology Theory and Procedures. Philadephia: Wolter Kluwer 2018: P. 704. 23. Rodak B.F., Fritsma G.A., Keohane F.A. Hematology, Clinical Principles and Application. Elsevier 2020: P. 905. 24. Flatt J.F., Bawazir W.M., Bruce L.J. The involvement of cation leaks in the storage lesion of red blood cells. Frontiers in physiology 2014; 5: 214. doi: 10.3389/fphys.2014.00214. 25. Shrivastava M. The platelet storage lesion. Transfusion and apheresis science: official journal of the World Apheresis Association: official journal of the European Society for Haemapheresis 2009; 41(2): 105-113. doi: 10.1016/j.transci.2009.07.002. 26. Buttarello M., Plebani M. Automated blood cell counts: state of the art. American journal of clinical pathology 2008; 130(1): 104-116. doi: 10.1309/EK3C7CTDKNVPXVTN. 27. Briggs C., Culp N., Davis B. et al. ICSH guidelines for the evaluation of blood cell analysers including those used for differential leucocyte and reticulocyte counting. International journal of laboratory hematology 2014; 36(6): 613-627. doi: 10.1111/ijlh.12201.
Corresponding Author: Shulga Alexander; e-mail: contrarius@yandex.ru. Conflict of interest. None declared. Funding. The study had no sponsorship. Abstract Sample stability is essential for reliable results in clinical laboratory practice. The aim of the work was to investigate the change in values of hematological indices in samples stored for up to 72 hours under different temperature regimes. A total of 60 whole blood samples stored under different conditions were analyzed: at room temperature (25°C), heated to 35°C and cooled to 4°C. Analysis was performed at different time points: immediately after blood sampling and then consecutively after 3, 6, 12, 24, 48 and 72 hours. K2EDTA anticoagulant tubes were used, and results were obtained using a UniCel DxH 800 hematology analyzer. The median shift of the parameters relative to baseline for each combination of time and temperature was assessed using the Wilcoxon matched pairs test. The shift in hemogram values obtained using Bland-Altman plots was compared with the maximum permissible error specified in the quality specification for the desirable error. Hemoglobin, erythrocyte count, mean erythrocyte hemoglobin content and platelet content were stable for at least 72 hours at all temperatures used in the experiment. For the other tested parameters, the first unacceptable changes in hemogram values were observed after 3 hours when the samples were stored at 25°C and 35°C. In samples cooled to 4°C, the first statistically significant differences were recorded after 6 hours. As a result, storage of samples for 72 hours at room temperature led to reliable unacceptable changes in 6 hemogram parameters of the 11 studied, at 4°C 5 parameters changed unacceptably, and at 35°C – 7 parameters. The obtained results, on the one hand, indicate that when analyzing the results of hematological tests is performed with a delay after sample collection, changes in hematological parameters should be considered; on the other hand, they provide information about the list of parameters subject to temperature-time changes, as well as about the intensity of these changes. Key words stability of samples, storage conditions, hematological tests, hematological analyzers References 1. Kishkun A.A. Aktual'nost' problemy centralizacii klinicheskih laboratornyh issledovanij dlja sistemy zdravoohranenija strany. [Relevance of the problem of centralization of clinical laboratory research for the country's health care system]. Laboratornaja medicina [Laboratory Medicine] 2011; (11): 29-34. (In Russ.) 2. Kishkun A.A. Centralizacija laboratornyh issledovanij kak sovremennaja paradigma povyshenija jekonomicheskoj i klinicheskoj jeffektivnosti laboratornoj diagnostiki. [Centralization of laboratory research as a modern paradigm for increasing the economic and clinical efficiency of laboratory diagnostics]. Klinicheskaja laboratornaja diagnostika [Clinical laboratory diagnostics] 2013; (9): 4. (In Russ.) 3. Godkov M.A. Principy centralizacii laboratornyh issledovanij. [Principles of centralization of laboratory research]. Laboratornaja sluzhba [Laboratory Service] 2015; (4): 3-10. (In Russ.) 4. Men'shikov V.V. Optimizacija rashodov na zdravoohranenie, centralizacija laboratornyh issledovanij i dostupnost' laboratornoj informacii. [Optimization of health care costs, centralization of laboratory research and availability of laboratory information]. Klinicheskaja laboratornaja diagnostika [Clinical laboratory diagnostics] 2014; (59): 4. (In Russ.) 5. Gil'manov A.A., Hajrullin I.I., Nurmyeva L.A. et al. Centralizacija laboratornoj sluzhby gosudarstvennyh medicinskih uchrezhdenij goroda na baze kliniko-diagnosticheskoj laboratorii krupnogo mnogoprofil'nogo stacionara. [Centralization of the laboratory service of state medical institutions of the city on the basis of the clinical diagnostic laboratory of a large multidisciplinary hospital]. Menedzher zdravoohranenija [Healthcare Manager] 2013; (11): 14-22. (In Russ.) 6. Adcock Funk D.M., Lippi G., Favaloro E.J. et al. Quality standards for sample processing, transportation, and storage in hemostasis testing. Seminars in thrombosis and hemostasis 2012; 38(6):576-585. doi:10.1055/s-0032-1319768. 7. Lippi G., Guidi G.C., Mattiuzzi C. et al. Preanalytical variability: the dark side of the moon in laboratory testing. Clinical chemistry and laboratory medicine 2006; 44(4):358-365. doi:10.1515/CCLM.2006.073. 8. Murray L.P., Baillargeon K.R., Bricknell J.R. et al. Determination of sample stability for whole blood parameters using formal experimental design. Analytical Methods 2019; 11(7):930-935. doi:10.1039/C8AY02351D. 9. Zini G. International Council for Standardization in Haematology (ICSH). Stability of complete blood count parameters with storage: toward defined specifications for different diagnostic applications. International journal of laboratory hematology 2014; 36(2):111-113. doi:10.1111/ijlh.12181. 10. Daves M., Zagler E.M., Cemin R. et al. Sample stability for complete blood cell count using the Sysmex XN haematological analyser. Blood transfusion = Trasfusione del sangue 2015; 13(4):576-582. doi:10.2450/2015.0007-15. 11. Joshi A., McVicker W., Segalla R. et al. Determining the stability of complete blood count parameters in stored blood samples using the SYSMEX XE-5000 automated haematology analyser. International journal of laboratory hematology 2015; 37(5):705-714. doi:10.1111/ijlh.12389. 12. Buoro S., Mecca T., Seghezzi M. et al. Assessment of blood sample stability for complete blood count using the Sysmex XN-9000 and Mindray BC-6800 analyzers. Revista brasileira de hematologia e hemoterapia 2016; 38(3):225-239. doi:10.1016/j.bjhh.2016.05.010. 13. Pintér E., László K., Schüszler I. et al. The stability of quantitative blood count parameters using the ADVIA 2120i hematology analyzer. Practical laboratory medicine 2015; 4:16-21. doi:10.1016/j.plabm.2015.12.001. 14. Oliveira L.R., Simionatto M., Cruz B.R. et al. Stability of complete blood count in different storage conditions using the ABX PENTRA 60 analyzer. International journal of laboratory hematology 2018; 40(3):359-365. doi:10.1111/ijlh.12797. 15. Ricós C., Alvarez V., Cava F. et al. Current databases on biological variation: pros, cons and progress. Scandinavian journal of clinical and laboratory investigation 1999; 59(7):491-500. doi:10.1080/00365519950185229. 16. Imeri F., Herklotz R., Risch L. et al. Stability of hematological analytes depends on the hematology analyser used: a stability study with Bayer Advia 120, Beckman Coulter LH 750 and Sysmex XE 2100. Clinica chimica acta; international journal of clinical chemistry 2008; 397(1-2):68-71. doi:10.1016/j.cca.2008.07.018. 17. Bruegel M., Nagel D., Funk M. et al. Comparison of five automated hematology analyzers in a university hospital setting: Abbott Cell-Dyn Sapphire, Beckman Coulter DxH 800, Siemens Advia 2120i, Sysmex XE-5000, and Sysmex XN-2000. Clinical chemistry and laboratory medicine 2015; 53(7):1057-1071. doi:10.1515/cclm-2014-0945. 18. Bourner G., Dhaliwal J., Sumner J. Performance evaluation of the latest fully automated hematology analyzers in a large, commercial laboratory setting: a 4-way, side-by-side study. Laboratory hematology : official publication of the International Society for Laboratory Hematology 2005; 11(4):285-297. doi:10.1532/lh96.05036. 19. Johnson M., Samuels C., Jozsa N. et al. Three-way evaluation of high-throughput hematology analyzers-Beckman Coulter LH 750, Abbott Cell-Dyn 4000, and Sysmex XE-2100. Laboratory Hematology 2002; 8, 230-238. 20. Vogelaar S.A., Posthuma D., Boomsma D. et al. Blood sample stability at room temperature for counting red and white blood cells and platelets. Vascular pharmacology 2002; 39(3):123-125. doi:10.1016/s1537-1891(02)00298-7. 21. Rahmanitarini A., Hernaningsih Y., Indrasari Y.N. et al. The stability of sample storage for complete blood count (CBC) toward the blood cell morphology. Bali Medical Journal 2019; 8(2):391-395. doi:10.15562/bmj.v8i2.1369. 22. Turgeon M.L. Basic Laboratory Assessment of Erythrocytes, Leukocytes, and Platelets. Clinical Hematology Theory and Procedures. Philadephia: Wolter Kluwer 2018: P. 704. 23. Rodak B.F., Fritsma G.A., Keohane F.A. Hematology, Clinical Principles and Application. Elsevier 2020: P. 905. 24. Flatt J.F., Bawazir W.M., Bruce L.J. The involvement of cation leaks in the storage lesion of red blood cells. Frontiers in physiology 2014; 5:214. doi:10.3389/fphys.2014.00214. 25. Shrivastava M. The platelet storage lesion. Transfusion and apheresis science: official journal of the World Apheresis Association : official journal of the European Society for Haemapheresis 2009; 41(2):105-113. doi:10.1016/j.transci.2009.07.002. 26. Buttarello M., Plebani M. Automated blood cell counts: state of the art. American journal of clinical pathology 2008; 130(1):104-116. doi:10.1309/EK3C7CTDKNVPXVTN. 27. Briggs C., Culp N., Davis B. et al. ICSH guidelines for the evaluation of blood cell analysers including those used for differential leucocyte and reticulocyte counting. International journal of laboratory hematology 2014; 36(6):613-627. doi:10.1111/ijlh.12201. |
[ См. также ] Рубрики |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|