| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Негативное влияние длительного систематического приёма алкоголя на печень крыс
Автор для корреспонденции: Розенфельд Игорь Игоревич; e-mail: iiggo@mail.ru. Финансирование. Исследование не имело спонсорской поддержки. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Аннотация Экспериментальное исследование было проведено на 60 белых лабораторных крысах. Данная работа была проведена на самках крыс аутбредной популяции линии «Wistar» массой от 150 до 170 граммов и возрастом от года. Все животные были разделены на 3 исследовательские группы (по 20 особей в каждой): группа I (контрольная интактная группа), которой не давался алкоголь; группа II (первая опытная группа), в которой каждый день в течение 6 месяцев пероральным путём вводился 70% этиловый спирт в дозировке 1 мл; группа III (вторая опытная группа крыс) включала потомство от первой опытной группы после употребления алкоголя, им также каждый день в течение 6 месяцев вводился 70% этиловый спирт пероральным путём в дозировке 1 мл. Для оценки результатов животным выполнялась лапаротомия под эфирным наркозом с последующей биопсией печени и гистологической верификацией. В ходе исследований на лабораторных животных создана экспериментальная модель негативного влияния алкоголя на печень. Ключевые слова алкоголь, лапаротомия, белые крысы, гистологические препараты, биоптат, печень, беременность, потомство doi: 10.29234/2308-9113-2019-7-4-57-66 Для цитирования: Розенфельд И. И., Донсков С. А., Чиликина Д. Л., Акопян А. В., Кухарчук А. Н., Мамедсахатова Л. А., Пацоева Х. М. Негативное влияние длительного систематического приёма алкоголя на печень крыс. Медицина 2019; 7(4): 57-66 Введение Алкоголь (этиловый спирт; этанол; винный спирт; C2H5OH) – это бесцветная летучая жидкость с характерным запахом и жгучим вкусом, хорошо смешиваемая с водой [3]. Этиловый спирт широко распространен в живой природе. Малая диссоциация и очень слабая полимеризация небольших молекул этанола обусловливают его необычайную способность растворяться в воде и жирах и, следовательно, легко проходить через биологические мембраны. Данные свойства определяют его важную роль в физиологических и биохимических процессах, происходящих в организме [1]. Этанол является универсальным цитоплазматическим ядом, который разрушающе действует на все системы и органы человека. При систематическом употреблении алкоголя существенно поражаются центральная и периферическая нервная система, сердце и сосуды, почки, лёгкие, половые железы, система крови, желудочно-кишечный тракт, а также печень [5]. Выделяют две стадии воздействия алкоголя на организм. Первая – всасывание или резорбция, вторая – выведение или же элиминация. Время всасывания считается от начала приёма алкоголя до достижения его максимальной концентрации в крови. Этот период у разных людей протекает с различной скоростью, которая может варьироваться от 2 до 6 часов. Период выведения начинается лишь после того, как концентрация алкоголя в крови достигнет показателя свыше 90%. 2-10% алкоголя выделяется из организма в неизменном виде через мочу, кал, пот. Этот процесс происходит в течение 8‑12 часов. Остальное количество алкоголя окисляется в организме. Таким образом, выводится он гораздо дольше, чем всасывается [2,10]. Токсическое действие экзогенного этанола на организм чрезвычайно сложно и многообразно. Окисление этанола осуществляется преимущественно в печени, где метаболизируется до 90% введённого в организм алкоголя, что приводит к изменениям этого органа [4,8]. Остальные 10% алкоголя обезвреживают другие органы [9]. Печень выполняет в человеческом организме огромное количество функций. Она играет важную роль во всех обменных процессах, выполняет детоксикационную функцию. Когда человек употребляет алкоголь, на печень возлагается обязанность окислять этиловый спирт алкоголя до ацетата альдегида, а затем до уксусной кислоты, а следующим этапом до воды и углекислого газа. Безусловно, клетки печени очень сильно страдают от влияния алкоголя на них. Отмирая, клетки печени замещаются либо жировой тканью (развивается алкогольный стеатогепатоз), либо соединительной тканью (гепатофиброз и цирроз печени) [6,11]. Употребление алкоголя женщиной до и во время беременности ведёт к токсикозу беременности, выкидышам, преждевременным родам, внутриутробным порокам развития ребёнка, дефициту массы плода к моменту рождения, замедлению темпов психофизического развития. Родившиеся от пьяных родителей умственно отсталые люди неизбежно дают такое же потомство [7]. Целью настоящего исследования явилось выявление закономерности влияния алкоголя на печень крыс и их потомство, которых длительно поили этиловым спиртом, а также изучение гистологических препаратов, которые позволяют визуализировать и оценить структурные изменения печени. Материалы и методы Все эксперименты на лабораторных животных были выполнены в соответствии с "Правилами проведения работ с использованием экспериментальных животных", утверждёнными приказом Министерства здравоохранения СССР № 755 от 12.08.1977 года, и основываясь на положениях Хельсинской декларации Всемирной медицинской ассоциации от 1964 года, дополненной в 1975, 1983, 1989 и 2000 годы. Экспериментальные манипуляции выполнялись в соответствии с международными рекомендациями по использованию животных в биологических и медицинских исследованиях (1986), методическими рекомендациями "Деонтология медико-биологического эксперимента" (1987). Условия содержания и кормления экспериментальных животных осуществляли в соответствии "Санитарным правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник", утвержденным приказами Минздрава СССР № 1045 от 06.04.1973 года, № 1179 от 10.10.1983 года. Все животные содержались в стандартных условиях вивария с учётом требований к работе с экспериментальными животными. Выведение животных из эксперимента осуществляли в соответствии с Приказом № 742 от 13.11.1984 года "Об утверждении правил проведения работ с использованием экспериментальных животных". Исследовательская работа проводилась на базе экспериментальной лаборатории вивария и гистологической лаборатории кафедры гистологии ФГБОУ ВО Тверской ГМУ Минздрава России. Экспериментальное исследование проводилось на самках половозрелых белых лабораторных крысах линии "Wistar". В опыте использовались животные с массой тела от 150 до 170 граммов. В исследовании было использовано 60 белых лабораторных крыс. В работе использовались половозрелые самки возрастом от года. Все животные были разделены на следующие 3 исследовательские группы (по 20 особей в каждой). Группа I (контрольная интактная группа) – крысы с обычным рационом питания, где алкоголь не использовался. Рацион питания в этой группе применялся на основе приказа от 10.03.1966 года № 163 Министерства здравоохранения СССР "О нормах кормления лабораторных животных и продуцентов". Группа II (первая опытная группа) – беременные животные, которым каждый день в течение 6 месяцев пероральным путём вводился 70% этиловый спирт в дозировке 1 мл. Дозировка алкоголя была рассчитана на среднюю массу крысы. Группа III (вторая опытная группа) – взрослое потомство от первой опытной группы крыс, которым также каждый день в течение 6 месяцев вводился 70% этиловый спирт пероральным путём в дозировке 1 мл. Спустя 8 месяцев каждой крысе из трёх групп была проведена лапаротомия под ингаляционным этиловым эфирным наркозом с целью взятия биопсии печени для последующего гистологического исследования. Накануне дня операции животных мыли, операционное поле тщательно выбривалось и закрывалось повязкой. Перед операцией катетеризацией опорожнялся мочевой пузырь. Животных фиксировали в спинном положении с несколько приподнятой задней половиной туловища, что позволяло оттеснить к диафрагме органы брюшной полости, предотвратить выпирание кишечника в рану и тем самым создать большую свободу движений оперирующему хирургу. Клиновидной резекцией интраоперационным путём получали биоптат печени. Иссечённые участки печени фиксировали в 10% нейтральном растворе формалина, после чего проводили их в изопропиловом спирте с добавлением спирта "IsoPrep" (абсолютизированный изопропанол в концентрации не ниже 99,7% – ТритонХ15 – октилфеноксиполиэтоксиэтанол) и заливали в гомогенизированную парафиновую среду "HISTOMIX", формируя блоки. Из парафиновых блоков изготавливали серийные гистотопографические препараты толщиной 5-6 мкм и окрашивали их гематоксилином и эозином. Кроме вышеуказанной методики применяли гистохимическую окраску по Вейгерту – Ван Гизону с помощью набора готовых красителей производства итальянской фирмы "Bio-Optica Milano SPA". Применение указанных гистологических окрасок относится к числу интегрированных методов выявления эластических волокон, коллагена и ядер клеток соединительной ткани. При изучении микроскопических препаратов оценивали динамику развития воспалительной реакции в тканях печени, формирование рубца и особенности репаративной регенерации. Микроскопическое исследование, а также фоторегистрацию проводили на едином аппаратном комплексе, который включал в себя: исследовательский тринокулярный микроскоп "Nikon Eclipse 50i"; цифровую фотокамеру "Nikon DS-Fi 2"; персональный компьютер, работающий под управлением операционной системы "Windows 7"; специализированные морфометрические программы "NIS-Elements" и "Bio Vision Professional". При статистической обработке для корректного определения меры центральной тенденции и рассеяния осуществлялась проверка выборки на нормальность распределения с использованием средств автоматизации расчётов "MS Excel" и "VBA". Поскольку переменные выборки имели ненормальный характер распределения, то мерой центральной тенденции и рассеяния явилась медиана, верхний и нижний квартили. Для оценки одинакового признака в трёх независимых группах использовался непараметрический ранговый критерий Крускала-Уоллиса. При этом если выявлялось различие между исследуемыми группами (отвергалась нулевая гипотеза), то дополнительно при помощи непараметрического рангового Q-критерия Данна определялось, между какими именно попарными группами (I-II; I-III; II-III) есть достоверные статистически значимые различия. Различия считались статистически значимыми при уровне значимости p<0,05. Результаты исследования и их обсуждение Гистологические препараты контрольной группы крыс (группа I) окрашивали гематоксилином и эозином, толщина среза составила 5-6 микрон. Было установлено классическое строение печени с чётко просматривающимися триадами и центральными венами. В пространствах Диссе были обнаружены единичные эритроциты. Микроструктура печени в группе I соответствовала норме, какой-либо патологии не отмечалось (рисунок 1). В контрольной группе крыс окраска препаратов также осуществлялась по Вейгерту – Ван Гизону, которая предназначена для выявления коллагеновых (красный цвет) и эластических (от красных до коричневых) волокон. Соединительная ткань была развита слабо, в пространствах Диссе также отмечались единичные эритроциты, что соответствовало норме (рисунок 2). В ткани печени крыс первой опытной группы (группа II) были обнаружены множественные очаги кровоизлияний, а также жировые включения в гепатоцитах. Центральные вены были расширены, в просветах вен были обнаружены эритроциты и единичные нейтрофилы (рисунок 3). Рис. 1. Гистологические препараты печени контрольной группы крыс (группа I) 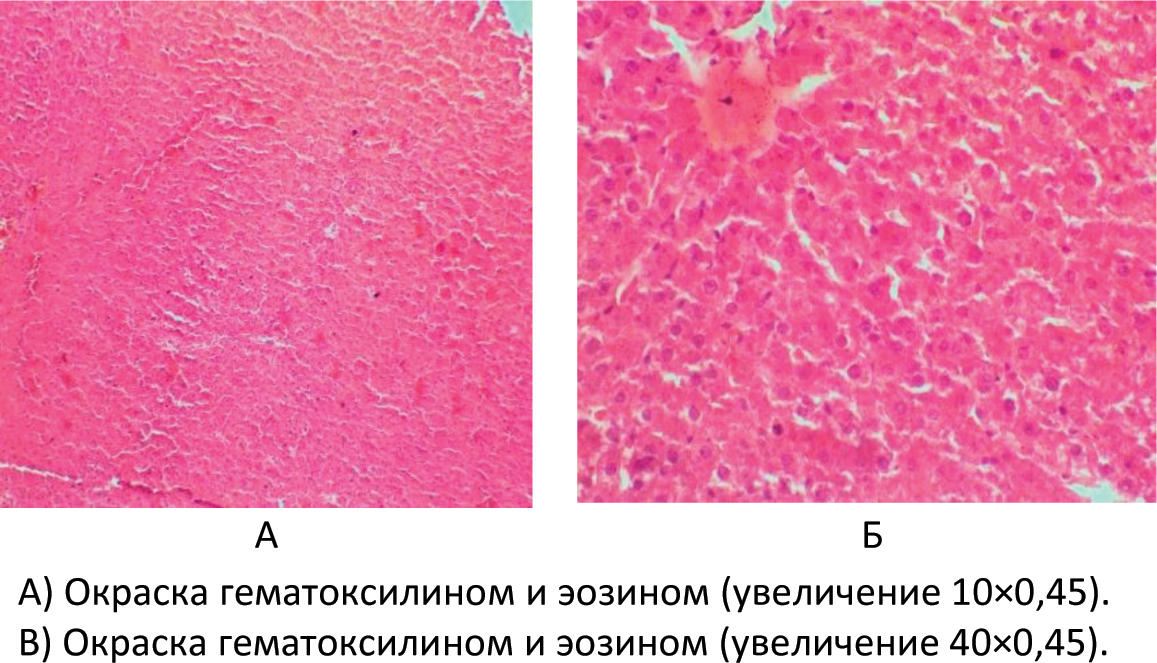 Рис. 2. Выявление коллагеновых волокон в печени контрольной группы крыс (группа I) при окраске по Вейгерту – Ван Гизону 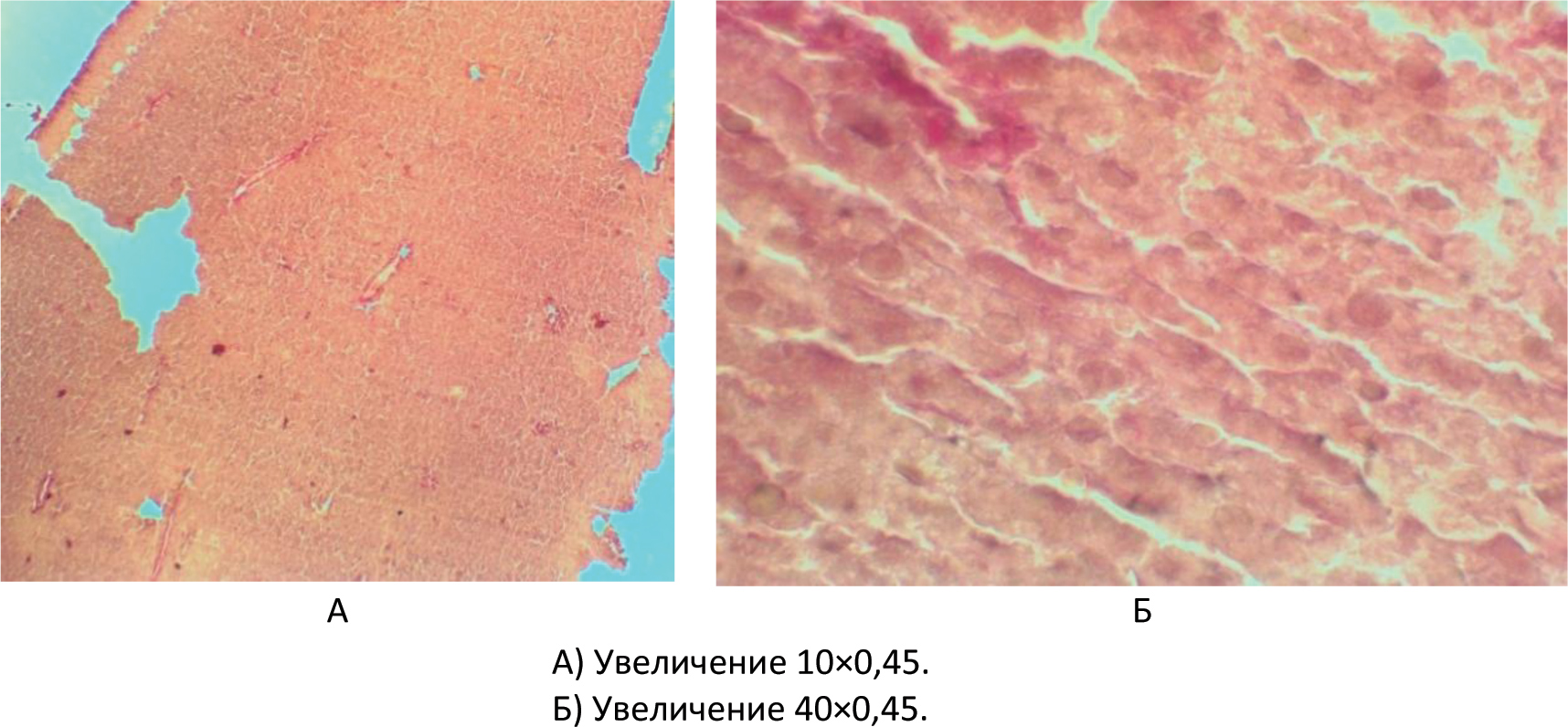 Рис. 3. Гистологические препараты печени первой опытной группы крыс (группа II), окрашенные гематоксилином и эозином 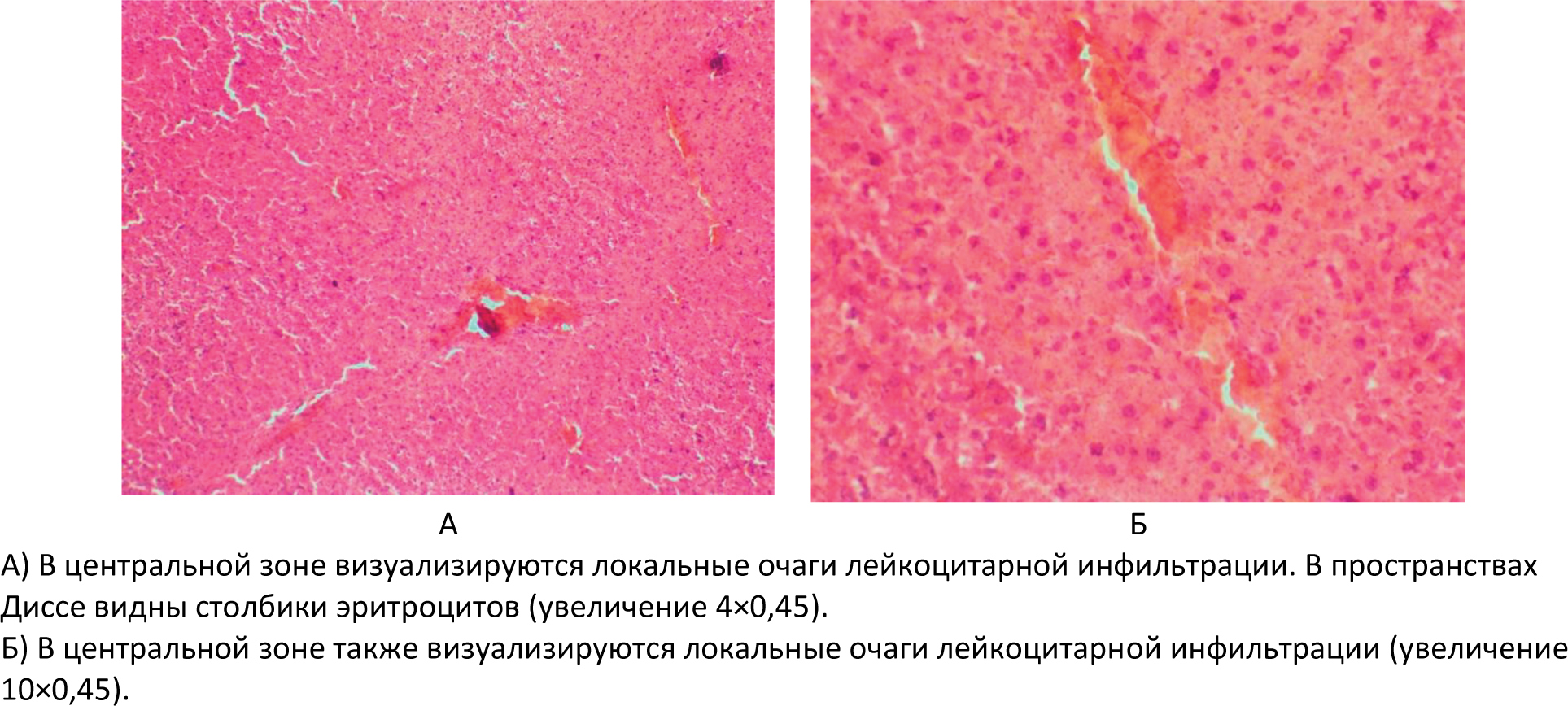 В ткани печени второй опытной группы крыс (группа III) были видны очаги более выраженных массивных кровоизлияний, единичные гепатоциты находились в состоянии некроза, отмечалась воспалительно-клеточная инфильтрация портальных трактов нейтрофилами (рисунок 4). Рис. 4. Гистологические препараты печени второй опытной группы крыс (группа III), окрашенные гематоксилином и эозином. Увеличение 40×0,45. 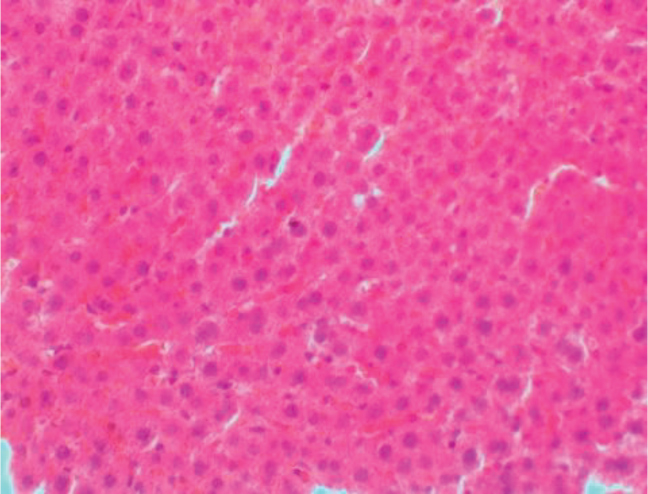 При окраске по Вейгерту – Ван Гизону в группе III наблюдалось разрастание соединительной ткани с формированием фиброза печени. При этом у этой группы после взятия биопсии наблюдалось кровотечение более 1,5 минут, которое в других группах моментально останавливалось (рисунок 5). Рис. 5. Гистологические препараты печени второй опытной группы крыс (группа III), окрашенные по Вейгерту – Ван Гизону 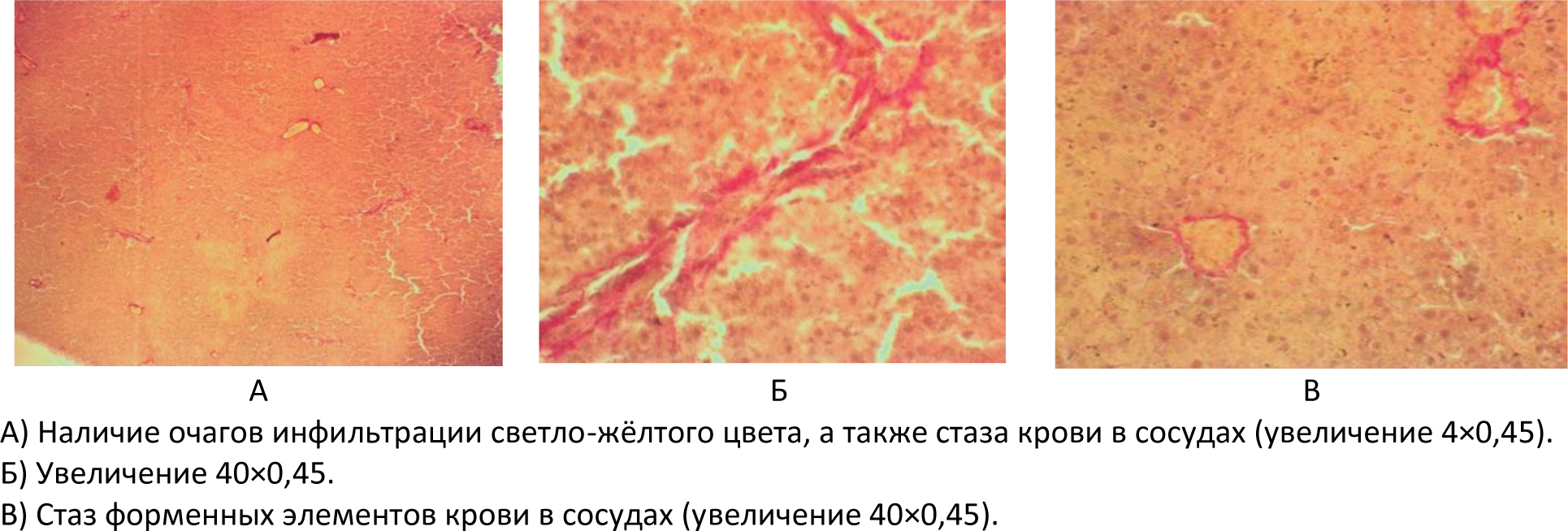 Заключение Экспериментальным путём доказано негативное влияние систематического употребления алкоголя на печень крыс. Кроме того, доказано ещё более пагубное влияние этанола в тех же дозировках на печень крыс, которые появились от алкоголизированных до этого беременных животных. Таким образом, выявлена генетическая предрасположенность, которая приводит к ещё более выраженной патологии печени в тех же дозировках этилового спирта по сравнению с крысами, получающими этанол, и которые были рождены не от алкоголизированных самок. Созданная экспериментальная модель на лабораторных животных может быть использована для сравнительной оценки употребления алкоголя женщинами во время беременности, а полученные при этом результаты будут максимально приближены к таковым в клинических условиях. Список литературы 1. Альтшулер В.Б. Алкоголизм. М.: Геотар-медиа, 2010. 2. Егоров А.Ю., Шайдукова Л.К. Современные особенности алкоголизма у женщин: возрастной аспект. 2005. 105 с. 3. Кириенко А.И., Шулутко А.М., Семиков В.И., Андрияшкин В.В. Хирургические болезни: учебно-методическое пособие. М.: Геотар-медиа, 2011. 497 с. 4. Марков В.К. Вредные привычки. М.: АСТ, 2010. 360 с. 5. Мухин Н.А., Моисеев В.С. Пропедевтика внутренних болезней: учебник. 2-е изд., доп. и перераб. М.: Геотар-медиа, 2011. 254 с. 6. Немцов А.В. Алкоголизм в России: история вопроса, современные тенденции. Журнал неврологии и психиатрии имени С. Корсакова. 2008; 2: 25-77. 7. Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. 3-е изд. М.: Бином. Лаборатория знаний, 2010. 344 с. 8. Рослый И.М. Алкоголизм. Крах белкового обмена. М.: Медицинское информационное агентство, 2013. 128 с. 9. Северин С.Е. Биологическая химия с упражнениями и задачами. М.: Геотар-медиа, 2011. 624 с. 10. Семёнов Б.С., Виденин В.Н., Вощевоз А.Т. Оперативная хирургия у животных. М.: 2012. 423 с. 11. Шабанов П.Д. Наркология. М.: 2013. 107 с.
Corresponding Author: Rozenfeld Igor; e-mail: iiggo@mail.ru. Conflict of interest. None declared. Funding. The study had no sponsorship. Abstract An experimental study was conducted on 60 white laboratory rats. This work was carried out on female rats of the out-bred population of the “Wistar” line weighing from 150 to 170 grams and the age of one year. All animals were divided into the following 3 research groups (20 animals each): group I (control intact group), which was not given alcohol; group II (the first experimental group), in which 70% ethyl alcohol was administered orally every day for 6 months at a dosage of 1 ml; group III (the second experimental group of rats) included offspring from the first experimental group after drinking alcohol; they also received 70% ethyl alcohol by oral route for 6 months every day at a dosage of 1 ml. To assess the results, the animals underwent laparotomy under ether anesthesia with subsequent liver biopsy and histological verification. In the course of research on laboratory animals, an experimental model of the negative effect of alcohol on the liver was created. Key words alcohol, laparotomy, white rats, histological preparations, biopsy, liver, pregnancy, offspring References 1. Al'tshuler V.B. Alkogolizm [Alcoholism] Moscow: Geotar-media, 2010. (In Russ.) 2. Egorov A.Yu., Shajdukova L.K. Sovremennye osobennosti alkogolizma u zhenshchin: vozrastnoj aspekt [Modern features of alcoholism in women: age aspect]. 2005. (In Russ.) 3. Kirienko A.I., Shulutko A.M., Semikov V.I., Andriyashkin V.V. Hirurgicheskie bolezni: uchebno-metodicheskoye. posobie [Surgical diseases: Teaching Aid]. Moscow: Geotar-med, 2011. (In Russ.) 4. Markov V.K. Vrednye privychki [Pernicious habits]. Moskva: AST, 2010. (In Russ.) 5. Muhin N.A., Moiseev V.S. Propedevtika vnutrennih boleznej: uchebnik. 2-e izd., dop. i pererab. [Propedeutics of internal diseases: textbook]. Moscow: Geotar-media, 2015. (In Russ.) 6. Nemcov A.V. "Alkogolizm v Rossii: istoriya voprosa, sovremennye tendencii [Alcoholism in Russia: background, current trends]." Zhurnal nevrologii i psihiatrii imeni S. Korsakova, no. 2 (2008): 25-77. (In Russ.) 7. Reutov O.A., Kurts A.L., Butin K.P. Organicheskaya himiya. 3-e izd. [Organic chemistry]. Moscow: Binom. Knowledge laboratory, 2010. (In Russ.) 8. Roslyj I.M. Alkogolizm. Krah belkovogo obmenа [Alcoholism. The collapse of protein metabolism]. Medical news Agency-Moscow, 2013. (In Russ.) 9. Severin S.E. Biologicheskaya himiya s uprazhneniyami i zadachami [Biological chemistry with exercises and tasks]. Moscow: Geotar-media, 2011. (In Russ) 10. Semyonov B.S., Videnin V.N., Voshchevoz A.T. Operativnaya hirurgiya u zhivotnyh [Operative surgery in animals], 2012. (In Russ.) 11. Shabanov P.D. Narkologiya [Narcology]. Moscow, 2013. (In Russ.) |
[ См. также ] Рубрики |
||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|