Авторы
Лукьяненко Н. В.
д.м.н., профессор, кафедра эпидемиологии, микробиологии и вирусологии1
Сурсякова К. И.
к.м.н., доцент, кафедра эпидемиологии, микробиологии и вирусологии1
Сафьянова Т. В.
д.м.н., заведующий, кафедра эпидемиологии, микробиологии и вирусологии1
Прокопьев В. В.
к.м.н., доцент, кафедра эпидемиологии, микробиологии и вирусологии1
Русских А. А.
преподаватель, кафедра эпидемиологии, микробиологии и вирусологии1
1ФГБОУ ВО «Алтайский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Барнаул, Российская Федерация
Автор для корреспонденции
Сурсякова Ксения Ивановна; e-mail: boydika@yandex.ru
Финансирование
Исследование не имело спонсорской поддержки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Аннотация
Введение: В последние десятилетия в России, как и во всем мире, отмечается стремительное распространение устойчивости возбудителей инфекционных заболеваний к антибактеральным препаратам (АБП). Развитие лекарственной резистентности приводит к появлению способности микроорганизмов сохранять свою жизнедеятельность, несмотря на применение этиотропной терапии. Наряду с множественной резистентностью к АБП все большую значимость приобретает гипервирулентность, связанная с приобретением дополнительного генетического материала и формированием новых генетических линий. Цель исследования: Провести сравнительную фенотипическую и генотипическую оценку основных возбудителей инфекций, связанных с оказанием медицинской помощи (ИСМП), выделенных от пациентов крупного многопрофильного стационара. Материалы и методы исследования: В рамках исследования было проведено полногеномное секвенирование 50 полирезистентных штаммов, выделенных от пациентов с ИСМП в крупной многопрофильной медицинской организации. Исследовано 40 штаммов бактерий K. pneumoniae, 8 штаммов A. baumannii и 2 штамма P. aeruginosa, выделенных в многопрофильном стационаре из клинических образцов. Выделение чистых культур выполнялось бактериологическим методом с использованием кровянного агара и селективных сред – агара МакКонки (BioMerieux, Франция) и агара Левина (OXOID, Великобритания). Антибиотикорезистентность штаммов выявляли диско-диффузионным методом. Результаты исследования и их обсуждение: По результатам проведенного исследования A. baumannii наиболее часто вызывал ИСМП в виде генерализованной инфекции в 50% случаях, что на 20,6% меньше, чем у K. pneumoniae. При оценке генотипической резистентности штаммов A. baumannii выявлено наличие генов, приобретенных карабапенемаз, относящихся к классам: OXA-48 (14,2%), OXA-23 (42,8%), OXA-40 (14,2%) и приобретенных генов бета-лактамаз расширенного спектра группы CTX-M (28,8%). При оценке генотипической резистентности штаммов K. pneumoniae выявлено наличие следующих генов резистентности: гены металло-b-лактамаз группы NDM (14,6%), гены карбапенемаз группы OXA-48-подобных (44,1%), гены бета-лактамаз расширенного спектра группы CTX-M (41,3%). Выводы: Полученные сравнительные данные исследования генотипической резистентности штаммов K. pneumoniae и A. baumannii в крупной медицинской организации края определяют клинико-эпидемиологические аспекты формирования госпитальных штаммов этих возбудителей; позволяют врачу клиницисту и эпидемиологу установить группы риска ИСМП, корректировать схемы лечения пациентов, повышать эффективность профилактических и противоэпидемических мероприятий и прогноз возникновения и распространения госпитальных штаммов.
Ключевые слова
инфекции, связанные с оказанием медицинской помощи, генотипическая резистентность, факторы риска, антибиотикорезистентность, гены резистентности
Для цитирования
Лукьяненко Н. В., Сурсякова К. И., Сафьянова Т. В., Прокопьев В. В., Русских А. А. Сравнительные аспекты фенотипической и генотипической характеристики штаммов возбудителей инфекций, связанных с оказанием медицинской помощи, выделенных от пациентов крупного многопрофильного стационара. Медицина 2025; 13(1): 33-46
DOI
Введение
Закрепившийся в последние годы термин «ESСAPE» объединяет группу бактерий и является аббревиатурой от первых букв их родовых наименований (Enterococcus faecium, Staphylococcus aureus, K. pneumoniae, Acinetobacter baumannii, P. aeruginosa и виды рода Enterobacter) [3,10,16].
Данная группа определяет спектр возбудителей, наиболее часто вызывающих ИСМП. Широкий полиморфизм свойств, позволяющий «избегать» антимикробного подавления антибиотиками представляет собой новую парадигму в патогенезе, трансмиссии и резистентности микроооганизмов [1,3,5,7,10,16].
В их составе наиболее часто встречаются K. pneumoniae. При достаточно хорошо изученных свойствах данных микроорганизмов, как части нормальной микробиоты желудочно-кишечного тракта, кожных покровов и верхних дыхательных путей здоровых людей, они являются одними из основных возбудителей ИСМП, включая инфекции мочевыводящих путей, бактериемию, пневмонию, гнойные абсцессы [1,2,6,17].
Формирование в последние годы госпитальных штаммов K. pneumoniae определяется появившейся способностью клебсиелл продуцировать бета-лактамазы, расщепляющие бета-лактамные антибиотики, связанной с широким использованием бета-лактамных антибиотиков (фторхинолонов и аминогликозидов), блокирующих синтез клеточной стенки бактерий и обладающих наименьшей токсичностью для человека. Согласно функциональной классификации бета-лактамазы обладают способностью расщепления сульбактамов и тазобактамов (функциональные группы 1, 2 и 3). Структурная классификация делит лактамазы по молекулярным классам A, B, C и D соответственно сходству и различиям их белковых последовательностей.
Установленные в последние годы бета-лактамазы расширенного спектра действия (БЛРС), относящиеся ко второй функциональной группе, обладают способностью расщеплять пенициллины, цефалоспорины и карбапенемы. В БЛРС входят ферменты семейств TEM, SHV, CTX-M, OXA и др. Для каждого из них установлены аллельные варианты, обеспечивающие устойчивость к третьему поколению цефалоспоринов, монобактамам и карбапенемам [1,2,6].
Наряду с множественной резистентностью все большую значимость приобретает гипервирулентность, также связанная с приобретением дополнительного генетического материала и формированием генетических линий, эффективно поддерживающих эти приобретенные детерминанты и определяемые с конвергенцией гипервирулентности и устойчивости к карбапенемам. Наряду с широко распространенной проблемой АБР в литературе описывается устойчивость K. pneumoniae к дезинфектантам и антисептикам Одним из механизмов устойчивости бактерий к дезинфектантам и антисептикам является экспрессия системы эффлюкса, которая кодируется генами qacE, qacEΔ1, cepA, широко распространенными среди грамотрицательных бактерий [1,2,6,17].
В настоящее время проблема инфекций, связанных с P. aeruginosa, является предметом изучения многих исследовательских коллективов в части генетических детерминант резистентности, их регуляции и передачи. Синегнойная палочка является постоянным объектом международных программ по мониторированию нозокомиальных патогенов и их резистентности. Данные мониторинга говорят о том, что распространенность карбапенемрезистентных штаммов P. aeruginosa растет [3,10,16,21].
Роль синегнойной палочки и ее резистентных форм в развитии нозокомиальных инфекций, муковисцидоза, ожоговой болезни изучается в России ФГБУ «ФНИЦЭМ им. Н.Ф. Гамалеи» (под руководством академика А.Л. Гинцбурга), ФБУН «ЦНИИ эпидемиологии» Роспотребнадзора (руководитель – академик РАН В.Г. Акимкин), ФГБНУ «НИИ вакцин и сывороток им. И.И. Мечникова» (руководитель – академик В.В. Зверев), НИИ скорой помощи им. Н.В. Склифосовского (руководитель – профессор РАН С.С. Петриков), ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» и другими научными коллективами [6,7,11,12].
Данный возбудитель обладает и природной (видовой) устойчивостью к ряду антибиотиков, включая ампициллин/амоксициллин, ампициллин-сульбактам, амоксициллин-клавуланат, цефалоспорины I и II поколения, цефазолин, цефотаксим, цефтриаксон, цефамицины (цефокситин, цефотетан), клиндамицин, даптомицин, гликопептиды (ванкомицин, тейкоплакин), фузидиевую кислоту, линезолид, макролиды, рифампицин, хинупристин-дальфопристин, эртапенем, хлорамфеникол (левомицетин), канамицин, неомицин, триметоприм, триметоприм-сульфаметоксазол, тетрациклины [6].
Основы этой устойчивости связаны с отсутствием мишеней для некоторых групп антибиотиков, наличием естественно продуцируемых бета-лактамаз и других ферментов, инактивирующих антибиотики, особенностями пориновой проницаемости, активностью эффлюкс-помп и базируются на комплексных механизмах [6,14,15,17]. A. baumannii также входит в группу «ESСAPE» и широко распространен в природе, а также во внутрибольничной среде. Он обладает множественными механизмами резистентности к антибиотикам и способен колонизировать желудочно-кишечный тракт, кожу пациента, рото- и носоглотку, конъюнктиву, влагалище и уретру. В то же время A. baumannii может являться причиной пневмонии, трахеобронхита, сепсиса, инфекций мочевыводящих путей, эндокардита, раневой и хирургической инфекции, инфекций кожи и мягких тканей (включая некротизирующий фасциит), менингита, вентрикулита, абсцессов мозга, интраабдоминальных абсцессов, хориоамнионита, остеомиелита, артрита, синусита и перитонита [6,8,14,15,17].
Проблема внутрибольничных инфекций, вызываемых A. baumannii, становится всё более актуальной из-за растущей резистентности данных микроорганизмов к антибактериальным препаратам. Во внутрибольничных условиях в 60% случаев он определяет вспышки во «взрослых» отделениях реанимации и интенсивной терапии. Оставшиеся 40% приходятся на отделения реанимации и интенсивной терапии новорожденных, ожоговые, нейрохирургические, хирургические, онкологические и гематологические отделения [8,9,13-15,17].
Механизмы устойчивости у грамотрицательных бактерий к антимикробным препаратам очень схожи и включают инактивацию антибиотика ферментами, систему эффлюкса, спонтанные мутации, изменяющие мишени действия для антибиотика или функции бактериальной клетки, а также, что характерно для A. baumannii и P. aeruginosa, сопровождающиеся снижением проницаемости наружной мембраны [8,9,13-15,17].
Важным звеном эпидемического процесса при инфекциях, вызванных грамотрицательными бактериями являются пациенты и персонал медицинских организаций, выступающие в роли своеобразной экологической ниши не только для передачи, но и для сохранения и селекции инфекционных агентов. Способствующими факторами являются: организация работы в этих отделениях – широкое использование инвазивных диагностических и лечебных мероприятий (катетеризация магистральных сосудов, искусственная вентиляция лёгких, длительная инфузионная терапия, энтеральное питание, методы внепочечного очищения крови), высокая концентрация больных с тяжелыми заболеваниями и сниженной иммунологической защитой, широкое и часто нерациональное использование антибактериальных и кортикостероидных препаратов, цитостатиков. A. baumannii в большинстве случаев вызывает заболевания у тяжелобольных иммуноскомпрометированных пациентов [13,14,18,19].
Совокупные данные об уровне антибиотикорезистентности, ее молекулярных механизмах распространения, наряду с генетической характеристикой штамма, такой как сиквенс-тип и генотип вирулентности, являются очень важной эпидемиологической информацией, поскольку позволяют определить происхождение штаммов, источник и пути распространения инфекции, методики лечения и предупреждения развития заболеваний [1,3,5,7,10,16,20,22].
Материалы и методы исследования
В рамках исследования было проведено полногеномное секвенирование 50 полирезистентных штаммов, выделенных от пациентов с инфекциями, связанных с оказанием медицинской помощи (ИСМП) в крупной многопрофильной медицинской организации. Исследовано 40 штаммов бактерий K. pneumoniae, 8 штаммов A. baumannii и 2 штамма P. aeruginosa, выделенных в многопрофильном стационаре из клинических образцов. Выделение чистых культур выполнялось бактериологическим методом с использованием кровянного агара и селективных сред – агара МакКонки (BioMerieux, Франция) и агара Левина (OXOID, Великобритания). Антибиотикорезистентность штаммов выявляли диско-диффузионным методом согласно МУК 4.2.1890-04 [2] по определению чувствительности к антимикробным препаратам с использованием агара Мюллера-Хинтона (OXOID, Великобритания) (рекомендации Европейского комитета EUCAST) [3].
Пробоподготовка проводилась с помощью набора Qiagen DNeasy Blood & Tissue Kit, секвенирование геномов – Illumina NextSeq 2000. Идентификация произведена посредством масс-спектрометра Microflex (производитель Bruker Daltonik GmbH & Co. KG Германия), с программным обеспечением MALDI Biotyper, и использованием референтской базы данных (содержит более 2500 видов МО и 7800 штаммов). Исследование включало эпидемиологические, статистические, математические методы исследования.
Результаты
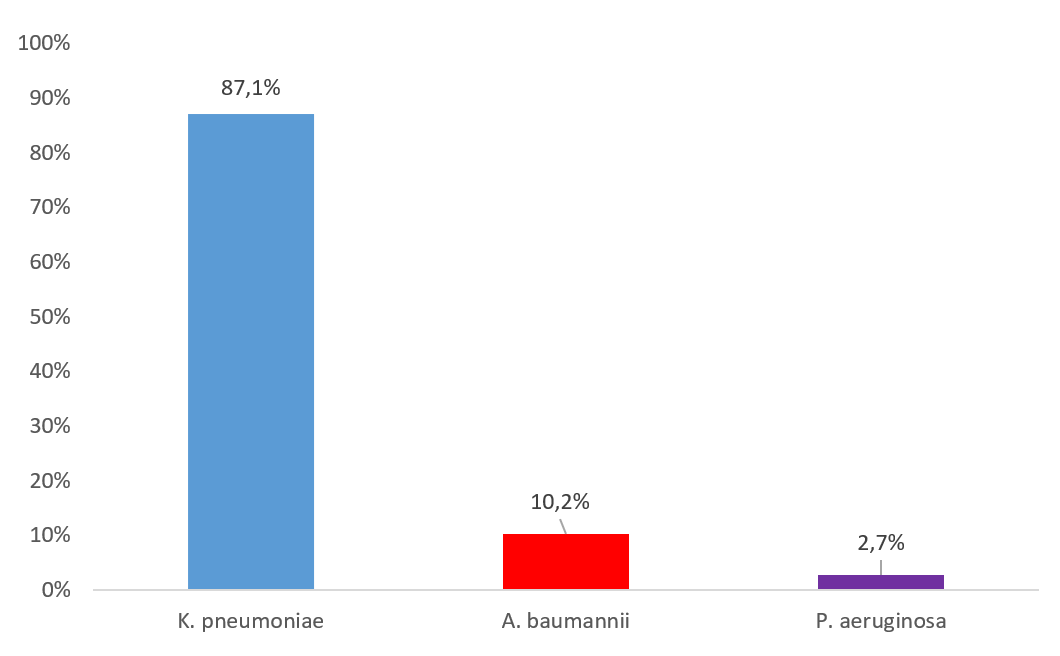
При проведении исследования проводился отбор клинического материала от пациентов с ИСМП, находящихся на стационарном лечении в различных отделениях крупной многопрофильной медицинской организации с апреля по июнь 2023 года. Наиболее частым возбудителем ИСМП была – K. pneumoniae (87,1%), на втором месте – A. baumannii (10,2%) и третьем – P. aeruginosa (2,7%) (рис 1.).
Рис. 1. Возбудители ИСМП, выделенные из клинического материала пациентов
Проведенный сравнительный анализ эндогенных и экзогенных факторов риска ИСМП у пациентов, из клинического материала которых выделены A. baumannii и P. aeruginosa, с группой больных, осложнения в которой определены K. pneumonia, не установил различий.
Определена разность показателей между группами при сравнении структуры и тяжести осложнений (рис. 2,3).
Рис. 2. Структура ИСМП, вызванных A. baumannii и P. aeruginosa
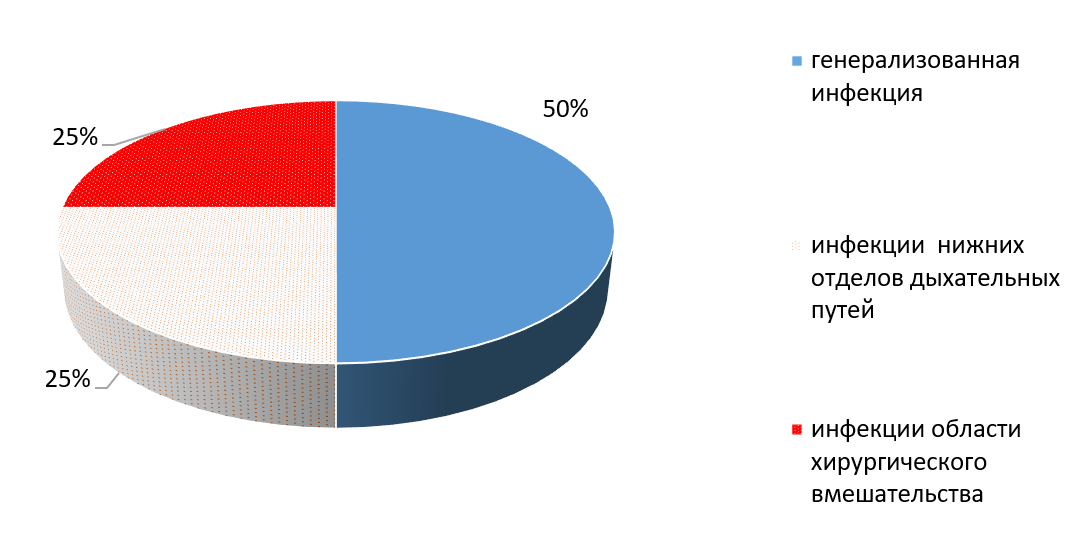
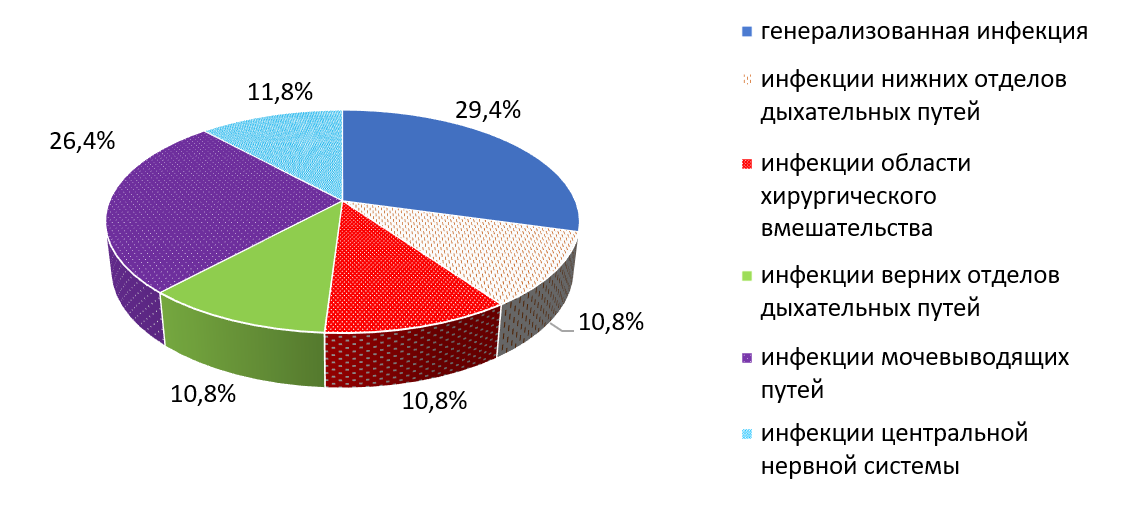
При сравнении частоты распространения инфекций нижних отделов дыхательных путей и инфекций области хирургического вмешательства, инфекций, вызванных A. baumannii и P. aeruginosa было больше на 14,2%, чем K. pneumoniae. В структуре осложнений группы пациентов, вызванными K. pneumoniae инфекции мочевыводящих путей составили 26,4%, верхних отделов дыхательных путей – 10,8%, при их отсутствии среди больных с A. baumannii и P. aeruginosa.
Рис. 3. Структура ИСМП, вызванных K. Pneumoniae
Установлена более высокая тяжесть осложнений (на 20,6%), определяемая генерализацией патологического процесса в группе больных, выделивших A. baumannii и P. aeruginosa.
Проведена фенотипическая оценка антибиотикорезистентности штаммов, выделенных из клинического материала пациентов. Установлено, что 7 описанных штаммов A. baumannii проявляли резистентность ко всем исследованным группам антибиотиков. Аналогичная ситуация установлена при оценке 2-х штаммов P. aeruginosa.
Из 40 штаммов K. pneumoniae полирезистентными были 17 (41,1%), остальные 24 (58,9%) проявляли частичную резистентность к различным группам антибиотиков.
При оценке генотипической резистентности штаммов семейства A. baumannii установлены следующие гены резистентности:
– ДНК генов карбапенемаз группы OXA-48-подобных – 14,2%;
– ДНК генов карбапенемаз групп OXA-23-подобных – 42,8%;
– ДНК генов карбапенемаз OXA-40-подобных – 14,2%;
– ДНК генов бета-лактамаз расширенного спектра группы CTX-M – 28,8%.
Гены резистентности P. aeruginosa выявить не удалось.
Генотипическая резистентность штаммов K. pneumoniae определялась:
– ДНК генов металло-b-лактамаз группы NDM – 14,6%;
– ДНК генов карбапенемаз группы OXA-48-подобных – 44,1%;
– ДНК генов бета-лактамаз расширенного спектра группы CTX-M – 41,3%.
У 14 пациентов наблюдалось сочетание ДНК генов карбапенемаз группы OXA-48-подобных + ДНК генов бета-лактамаз расширенного спектра группы CTX-M. У 3-х пациентов сочетание ДНК генов металло-b-лактамаз группы NDM + ДНК генов карбапенемаз группы OXA-48-подобных + ДНК генов бета-лактамаз расширенного спектра группы CTX-M.
Проведенный анализ генотипической резистентности штаммов A. baumannii свидетельствовал о наличии наиболее тяжелых ИСМП у изученных пациентов при установлении карбапенемаз группы OXA-23-подобных.
При сочетании ДНК генов карбапенемаз группы OXA-40-подобных + ДНК генов бета-лактамаз расширенного спектра группы CTX-M у одного из пациентов развилась ИСМП в виде двусторонней пневмонии.
При сочетании ДНК генов карбапенемаз группы OXA-48-подобных + карбапенемаз группы OXA-23-подобных + ДНК генов бета-лактамаз расширенного спектра группы CTX-M у одного из пациентов установлен диагноз местного отграниченного перитонита.
При обнаружении карбапенемаз группы OXA-23-подобных у одного пациента обнаружен перитонит, у другого – нагноение послеоперационной раны.
Сравнительный анализ генов, кодирующих механизмы устойчивости K. pneumoniae к антимикробным препаратам и осложнения в форме ИСМП приведен в табл. 1.
Таблица 1. Анализ генов, кодирующих механизмы устойчивости K. pneumoniae к антимикробным препаратам и осложнения в форме ИСМП
| ДНК генов металло-b-лактамаз группы VIM | ДНК генов металло-b-лактамаз группы IMP | ДНК генов металло-b-лактамаз группы NDM | ДНК генов карбапенемаз группы KPC | ДНК генов карбапенемаз группы OXA-48-подобных | ДНК генов карбапенемаз групп OXA-23-подобных | ДНК генов карбапенемаз OXA-58-подобных | ДНК генов карбапенемаз OXA-40-подобных | Осложнения |
|---|---|---|---|---|---|---|---|---|
| 0 | 0 | 2 | 0 | 1 | 0 | 0 | 0 | Хронический цистит |
| 0 | 0 | 4 | 0 | 1 | 0 | 0 | 0 | Нагноение п/опер раны |
| 0 | 0 | 2 | 0 | 4 | 0 | 0 | 0 | Перитонит |
| 0 | 0 | 2 | 0 | 7 | 0 | 0 | 0 | Сепсис |
| 0 | 0 | 0 | 0 | 6 | 0 | 0 | 0 | Острый цистит |
| 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | Двусторонний диффузный бронхит |
| 0 | 0 | 0 | 0 | 4 | 0 | 0 | 0 | Нозокомиаль-ная пневмония |
| 0 | 0 | 0 | 0 | 7 | 0 | 0 | 0 | Гнойный менинго-энцефалит |
| 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | Острый гнойный пиелонефрит |
| 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | Местный отграниченный перитонит |
При оценке ДНК генов металло-b-лактамаз группы NDM были отмечены следующие осложнения в форме ИСМП:
– Хронический цистит – 20%
– Нагноение п/опер раны – 40%
– Перитонит – 20%
– Сепсис – 20%
ДНК генов карбапенемаз группы OXA-48-подобных:
– Хронический цистит – 2,8%
– Нагноение п/опер раны – 2,8%
– Перитонит – 11,4%
– Сепсис – 20%
– Острый цистит – 17,4%
– Двусторонний диффузный бронхит – 8,5%
– Нозокомиальная пневмония – 11,4%
– Гнойный менингоэнцефалит – 20%
– Острый гнойный пиелонефрит – 2,8%
– Местный отграниченный перитонит – 2,9%
ДНК генов карбапенемаз групп OXA-23-подобных:
– Местный отграниченный перитонит – 100% (1 случай).
Обсуждение результатов
По результатам проведенного исследования A. baumannii наиболее часто вызывал ИСМП в виде генерализованной инфекции – в 50% случаях, что на 20,6% меньше, чем у K. pneumoniae.
При оценке генотипической резистентности штаммов A. baumannii выявлено наличие генов, приобретенных карабапенемаз, относящихся к классам: OXA-48 (14,2%), OXA-23 (42,8%), OXA-40 (14,2%) и приобретенных генов бета-лактамаз расширенного спектра группы CTX-M (28,8%).
Наши результаты только отчасти совпадают с данными полученными в исследовании «МАРАФОН 2015-2016», свидетельствовавшими о наличии у 76,2% изолятов A. Baumannii генов приобретенных карбапенемаз, относящихся к группам OXA-24/40 (57,5%), OXA-23 (18,4%) и OXA-58 (0,1%); причем у двух изолятов (0,2%) одновременное наличие генов OXA-24/40и OXA-23-подобных бета-лактамаз [5]. Это может свидетельствовать о появлении на территории Алтайского края изолятов A. baumannii с новыми генами приобретенной резистентности к антимикробным препаратам.
При оценке генотипической резистентности штаммов K. pneumoniae выявлено наличие следующих генов резистентности: гены металло-b-лактамаз группы NDM (14,6%), гены карбапенемаз группы OXA-48-подобных (44,1%), гены бета-лактамаз расширенного спектра группы CTX-M (41,3%). Результаты проведенного исследования совпадают с литературными данными о присутствие гена OXA-48 исключительно у штаммов K. pneumoniae ST395, выделенных от пациентов, находящихся на стационарном лечении в медицинских учреждениях федерального подчинения, в которые госпитализируются больные из различных регионов Российской Федерации [1]. Этот факт может свидетельствовать о распространении K. pneumoniae, несущего гена OXA-48, в Российской Федерации.
Полученные сравнительные данные исследования генотипической резистентности штаммов K. pneumoniae и A. baumannii в крупной медицинской организации края: определяют клинико-эпидемиологические аспекты формирования госпитальных штаммов этих возбудителей; позволяют врачу клиницисту и эпидемиологу установить группы риска ИСМП, корректировать схемы лечения пациентов, повышать эффективность профилактических и противоэпидемических мероприятий, прогнозировать возможность формирования госпитальных штаммов и исход заболевания посредством своевременного анализа данных микробиологического мониторинга.
Список литературы
1. Баранцевич Е.П., Баранцевич Н.Е., Шляхто Е.В. Продукция карбапенемаз нозокомиальными штаммами K. Pneumoniae в Санкт-Петербурге. Клиническая микробиология и антимикробная химиотерапия 2016; 18(3): 196-199.
2. Бочарова, Ю.А., Савинова Т.А., Чеботарь И.В. Хромосомные гены ESKAPE-патогенов, мутации в которых индуцируют антибиотикорезистентность. Клиническая микробиология и антимикробная химиотерапия 2023; 25(2): 187-201, doi: 10.36488/cmac.2023.2.187-201
3. Бочарова Ю.А. Молекулярно-генетические механизмы устойчивости P. aeruginosa к антибиотикам группы карбапенемов. Автореф. дисс. на соискание ученой степени к.м.н. М., 2018.
4. Лазарева А.В., Чеботарь И.В., Крыжановская О.А., Чеботарь В.И., Маянский Н.А. P. aeruginosa: патогенность, патогенез и патология. Клиническая микробиология и антимикробная химиотерапия 2015; 17(3): 170-186.
5. Лазарева И.В., Агеевец В.А., Ершова Т.А., Зуева Л.П., Гончаров А.Е., Дарьина М.Г., Светличная Ю.С., Усков А.Н., Сидоренко С.В. Распространение и антибактериальная резистентность грамотрицательных бактерий, продуцентов карбапенемаз, в Санкт-Петербурге и некоторых других регионах Российской Федерации Антибиотики и химиотерапия 2016; 61(11-12): 28-38.
6. Методические указания МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам». М.: Роспотребнадзор, 2004.
7. Орлова О.А., Семененко Т.А., Акимкин В.Г. Сравнительный анализ эффективности использования бактериологических и молекулярно-биологических методов для оценки микробной обсемененности объектов внутрибольничной среды. Журнал микробиологии, эпидемиологии и иммунобиологии 2019; (4): 73-78.
8. Припутневич Т.В., Любасовская Л.А., Трофимов Д.Ю., Донников А.Е., Быстрицкий А.А. Место молекулярно-генетических методов в мониторинге и диагностике оппортунистических инфекций, в том числе связанных с оказанием медицинской помощи, у пациентов неонатального и акушерско-гинекологического профиля. Акушерство и гинекология. Новости. Мнения. Обучение 2020; 8(1): 53-61.
9. Рекомендации Европейского комитета EUCAST по определению чувствительности к антимикробным препаратам. [Электронный ресурс]. Режим доступа: https://www.antibiotic.ru/library/eucast-disk-diffusion-manual-8-0-rus/ (дата обращения: 01.07.2024).
10. Рубцова М.Ю., Уляшова М.М., Бахман Т.Т., Шмид Р.Д., Егоров А.М. Мультипараметрическое определение генов и точечных мутаций в них для идентификации бета-лактамаз. Успехи биологической химии 2010; 50: 303-348.
11. Слукин П.В., Лев А.И., Асташкин Е.И., Светоч Э.А., Фурсова Н.К. Создание базы данных клинических штаммов грамотрицательных бактерий для изучения молекулярных механизмов антибиотикорезистентности. Бактериология 2018; 3(1): 26-32.
12. Фармакология с рецептурой: учебник для медицинских и фармацевтических учреждений среднего профессионального образования. Под ред. В. М. Виноградова. 6-е изд., испр. и доп. СПб.: СпецЛит, 2016. 647 с.
13. Хохлова О.Е., Ларионова И.А., Перьянова О.В., Козлов Р.С., Эйдельштейн М.В., Модестов А.А., Еремеева О.Г., Лазарева И.В., Акушева Д.Н., Лобова Т.И., Поткина Н.К., Сидоренко С.В., Ямамото Т. Механизмы антибиотикорезистентности основных возбудителей гнойно-септических осложнений у онкологических больных. Инфекция и иммунитет 2021; 11(2): 324-336.
14. Эйдельштейн М.В. Бета-лактамазы аэробных грамотрицательных бактерий: характеристика, основные принципы классификации, современные методы выявления и типирования. Клиническая микробиология и антимикробная химиотерапия 2001; 3(3): 223-242.
15. Эйдельштейн М.В. Экстремально- и панрезистентные клоны бактериальных возбудителей в клинике. Материалы ежегодной Всероссийской научно-практической конференции с международным участием «Контроль и профилактика инфекций, связанных с оказанием медицинской помощи (ИСМП-2015). Москва 23-24 ноября 2015 года». МедиАль 2015; (3): 32-108.
16. Alcock B.P., Raphenya A.R., Lau T.T.Y., et al. CARD 2020: Antibiotic Resistome Surveillance with the Comprehensive Antibiotic Resistance Database. Nucleic Acids Research 2020; 48(D1): D517-D525, doi: 10.1093/nar/gkz935
17. Falagas M.E., Lourida P., Poulikakos P., Rafailidis P.I., Tansarli G.S. Antibiotic treatment of infections due to carbapenem-resistant Enterobacteriaceae: systematic evaluation of the available evidence. Antimicrob Agents Chemother 2014; 58(2): 654-663, doi: 10.1128/AAC.01222-13
18. Borges C.A., de Cássia de Andrade M.R., Vieira M.A., Souza L.A. C. Multidrug resistance genes, including blaKPC and blaCTX–M-2, among K. pneumoniae isolated in Recife, Brazil. Rev Soc Bras Med Trop 2012; 45(5): 572-578, doi: 10.1590/s0037-86822012000500007
19. Nordmann P., Poirel L., Walsh T.R., Livermore D.M. The emerging NDM carbapenemases. Trends Microbiol 2011; 19(12): 588-59, doi: 10.1016/j.tim.2011.09.005
20. Monaco M., Giani T., Raffone M., et al. Colistin resistance superimposed to endemic carbapenemresistant K. pneumoniae: a rapidly evolving problem in Italy, November 2013 to April 2014. Euro Surveill 2014; 19(42): 2093, doi: 10.2807/1560-7917.es2014.19.42.20939
21. Yamamoto M., Pop-Vicas A.E. Treatment for infections with carbapenem-resistant Enterobacteriaceae: what options do we still have? Critical Care 2014; 18(3): 229, doi: 10.1186/cc13949
Comparative Aspects of Phenotypic and Genotypic Characteristics of Strains of ISMP Pathogens Isolated from Patients of a Large Multidisciplinary Hospital
Authors
Lukyanenko N. V.
Doctor of Medicine, Professor, Chair for Epidemiology, Microbiology and Virology1
Sursyakova K. I.
MD, PhD, Assistant Professor, Chair for Epidemiology, Microbiology and Virology1
Safyanova T. V.
Doctor of Medicine, Head, Chair for Epidemiology, Microbiology and Virology1
Prokopyev V. V.
MD, PhD, Assistant Professor, Chair for Epidemiology, Microbiology and Virology1
Russkikh A. A.
Lecturer, Chair for Epidemiology, Microbiology and Virology1
1 - Altai State Medical University of the Ministry of Health of the Russian Federation, Barnaul, Russian Federation
Corresponding Author
Sursyakova Ksenia Ivanovna; e-mail: boydika@yandex.ru
Conflict of interest
None declared.
Funding
The study had no sponsorship.
Abstract
Introduction: In recent decades, Russia, like the rest of the world, has seen a rapid increase in antimicrobial resistance (AMR) among pathogens causing infectious diseases. The development of drug resistance leads to microorganisms' ability to survive despite the use of etiotropic therapy. Alongside multidrug resistance (MDR), hypervirulence – associated with the acquisition of additional genetic material and the emergence of new genetic lineages – is becoming increasingly significant. The purpose of the study: To conduct a comparative phenotypic and genotypic assessment of the main pathogens causing healthcare-associated infections (HAIs) isolated from patients in a large multidisciplinary hospital. Materials and methods: The study involved whole-genome sequencing of 50 multidrug-resistant (MDR) strains isolated from patients with HAIs in a major multidisciplinary healthcare facility. The sample included 40 K. pneumoniae strains, 8 A. baumannii strains, and 2 P. aeruginosa strains obtained from clinical specimens in a multidisciplinary hospital. Pure cultures were isolated using bacteriological methods with blood agar and selective media – MacConkey agar (BioMerieux, France) and Levin agar (OXOID, UK). Antibiotic resistance was determined using the disk diffusion method. The results of the study and their discussion. The study found that A. baumannii most frequently caused HAIs in the form of systemic infections (50% of cases), which was 20.6% less than K. pneumoniae. Genotypic analysis of A. baumannii revealed the presence of acquired carbapenemase genes, including: OXA-48 (14.2%), OXA-23 (42.8%), OXA-40 (14.2%) and extended-spectrum beta-lactamase (ESBL) genes of the CTX-M group (28.8%). For K. pneumoniae, the following resistance genes were identified: Metallo-beta-lactamases (MBLs) of the NDM group (14.6%), Carbapenemases of the OXA-48-like group (44.1%), ESBL genes of the CTX-M group (41.3%). Conclusions: The comparative data on the genotypic resistance of K. pneumoniae and A. baumannii strains in a large regional healthcare facility highlight the clinical and epidemiological aspects of hospital-acquired strain formation. These findings help clinicians and epidemiologists identify high-risk groups for HAIs, adjust treatment regimens, improve preventive and infection control measures, and predict the emergence and spread of hospital-resistant strains.
Key words
healthcare-associated infections, genotypic resistance, risk factors, antibiotic resistance, resistance genes
DOI
References
1. Barancevich E.P. Produkciya karbapenemaz nozokomial'nymi shtammami K. Pneumoniae v Sankt-Peterburge. [Production of Carbapenemases in Klebsiella Pneumoniae Isolated in Saint-Petersburg.] Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya [Clinical Microbiology and Antimicrobial Chemotherapy] 2016; 18(3): 196-199 (In Russ.)
2. Bocharova, Yu.A., Savinova T.A., Chebotar' I.V. Hromosomnye geny ESKAPE-patogenov, mutacii v kotoryh induciruyut antibiotikorezistentnost'. [Antimicrobial Resistance-Associated Mutations in Chromosomal Genes of Eskape Pathogens.] Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya [Clinical Microbiology and Antimicrobial Chemotherapy] 2023; 25(2): 187-201, doi: 10.36488/cmac.2023.2.187-201 (In Russ.)
3. Bocharova Yu. A. Molekulyarno-geneticheskie mekhanizmy ustojchivosti P. aeruginosa k antibiotikam gruppy karbapenemov. [Molecular genetic mechanisms of P. aeruginosa resistance to carbapenem antibiotics.] Avtoref. diss. na soiskanie uchenoj stepeni k.m.n. [Author’s Abstract, PhD Thesis.] Moscow, 2018. (In Russ.)
4. Lazareva A.V., Tchebotar I.V., Kryzhanovskaya O.A., Tchebotar V.I., Mayanskiy N.A. P. aeruginosa: patogennost', patogenez i patologiya. [Pseudomonas Aeruginosa: Pathogenicity, Pathogenesis and Diseases.] Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya [Clinical Microbiology and Antimicrobial Chemotherapy] 2015; 17(3): 170-186. (In Russ.)
5. Lazareva, I.V., Ageevec V.A., Ershova T.A., Zueva L.P., Goncharov A.E., Dar'ina M.G., Svetlichnaya Yu.S., Uskov A.N., Sidorenko S.V. Rasprostranenie i antibakterial'naya rezistentnost' gramotricatel'nyh bakterij, producentov karbapenemaz, v Sankt-Peterburge i nekotoryh drugih regionah Rossijskoj Federacii. [Prevalence and Antibiotic Resistance of Carbapenemase-Producing Gram-Negative Bacteria in Saint Petersburg and Some Other Regions of the Russian Federation.] Antibiotiki i himioterapiya [Antibiotics and Chemotherapy] 2016; 61(11-12): 28-38. (In Russ.)
6. Metodicheskie ukazaniya MUK 4.2.1890-04 «Opredelenie chuvstvitel'nosti mikroorganizmov k antibakterial'nym preparatam». [Methodological guidelines MUK 4.2.1890-04 «Determination of the sensitivity of microorganisms to antibacterial drugs.»] Moscow: Rospotrebnadzor, 2004. (In Russ.).
7. Orlova O. A., Semenenko T. A., Akimkin V. G. Sravnitel'nyj analiz effektivnosti ispol'zovaniya bakteriologicheskih i molekulyarno-biologicheskih metodov dlya ocenki mikrobnoj obsemenennosti ob«ektov vnutribol'nichnoj sredy. [Comparative Analysis of Efficiency of Bacteriological and Molecular-Biological Methods for the Assessment of Microbial Contamination of Hospital Environment Objects.] Zhurnal mikrobiologii, epidemiologii i immunobiologii [Journal of Microbiology, Epidemiology, Immunobiology] 2019; (4): 73-78. (In Russ.)
8. Priputnevich T.V., Lyubasovskaya L.A., Trofimov D.Yu., Donnikov A.E., Bystrickij A.A. Mesto molekulyarno-geneticheskih metodov v monitoringe i diagnostike opportunisticheskih infekcij, v tom chisle svyazannyh s okazaniem medicinskoj pomoshchi, u pacientov neonatal'nogo i akushersko-ginekologicheskogo profilya. [Molecular Genetic Methods as a Key-Point of Monitoring and Diagnostics of Opportunisctic Infections Including Nosocomial Among Neonatal and Ob-Gyn Patients.] Akusherstvo i ginekologiya. Novosti. Mneniya. Obuchenie. [Obstetrics and Gynecology. News. Views. Education] 2020; 8(1): 53-61. (In Russ.)
9. Rekomendacii Evropejskogo komiteta EUCAST po opredeleniyu chuvstvitel'nosti k antimikrobnym preparatam [Recommendations of the European EUCAST Committee on determining sensitivity to antimicrobial drugs.] Available at: https://www.antibiotic.ru/library/eucast-disk-diffusion-manual-8-0-rus/ (Assessed: 01.07.2024). (In Russ.)
10. Rubcova M.Yu., Ulyashova M.M., Bahman T.T., Shmid R.D., Egorov A.M. Mul'tiparametricheskoe opredelenie genov i tochechnyh mutacij v nih dlya identifikacii beta-laktamaz. [Multiparametric determination of genes and point mutations in them for the identification of beta-lactamases.] Uspekhi biologicheskoj himii [Biochemistry (Moscow)] 2010: 50: 303-348. (In Russ.)
11. Slukin P.V., Lev A.I., Astashkin E.I., Svetoch E.A., Fursova N.K. Sozdanie bazy dannyh klinicheskih shtammov gramotricatel'nyh bakterij dlya izucheniya molekulyarnyh mekhanizmov antibiotikorezistentnosti. [The Gram-Negative Bacterial Clinical Strains Database for Studying of Antibacterial Resistance Molecular Mechanisms.] Bakteriologiya [Bacteriology] 2018; 3(1): 26–32. (In Russ.)
12. Farmakologiya s recepturoj: uchebnik dlya medicinskih i farmacevticheskih uchrezhdenij srednego professional'nogo obrazovaniya. Pod red. V. M. Vinogradova. 6-e izd., ispr. i dop. [Pharmacology with a prescription: a textbook for medical and pharmaceutical institutions of secondary vocational education. Edited by V. M. Vinogradov. 6th ed.] Sankt-Peterburg: SpecLit, 2016. (In Russ.)
13. Hohlova O.E., Larionova I.A., Per'yanova O.V., Kozlov R.S., Ejdel'shtejn M.V., Modestov A.A., Eremeeva O.G., Lazareva I.V., Akusheva D.N., Lobova T.I., Potkina N.K., Sidorenko S.V., Yamamoto T. Mekhanizmy antibiotikorezistentnosti osnovnyh vozbuditelej gnojno-septicheskih oslozhnenij u onkologicheskih bol'nyh. [The Mechanisms of Antibiotic Resistance in Major Pathogens of Purulent-Inflammatory Complications in Cancer Patients] Infekciya i immunitet [Russian Journal of Infection and Immunity] 2021; 11(2): 324-336. (In Russ.)
14. Ejdel'shtejn M.V. Beta-laktamazy aerobnyh gramotricatel'nyh bakterij: harakteristika, osnovnye principy klassifikacii, sovremennye metody vyyavleniya i tipirovaniya [Beta-lactamases of aerobic gram-negative bacteria: characteristics, basic principles of classification, modern methods of detection and typing.] Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya [Clinical Microbiology and Antimicrobial Chemotherapy] 2001; 3(3): 223-242. (In Russ.)
15. Ejdel'shtejn M.V. Ekstremal'no- i panrezistentnye klony bakterial'nyh vozbuditelej v klinike. Materialy ezhegodnoj Vserossijskoj nauchno-prakticheskoj konferencii s mezhdunarodnym uchastiem »Kontrol' i profilaktika infekcij, svyazannyh s okazaniem medicinskoj pomoshchi (ISMP-2015) Moskva 23-24 noyabrya 2015 goda«. [Extreme and pan-resistant clones of bacterial pathogens in the clinic. Materials of the annual All-Russian Scientific and practical conference with international participation »Control and prevention of infections related to medical care (IMS-2015). Moscow, November 23-24, 2015«.] MediAl 2015; (3): 32-108(In Russ.)
16. Alcock B.P., Raphenya A.R., Lau T.T.Y., et al. CARD 2020: Antibiotic Resistome Surveillance with the Comprehensive Antibiotic Resistance Database. Nucleic Acids Research 2020; 48(D1): D517-D525, doi: 10.1093/nar/gkz935
17. Falagas M.E., Lourida P., Poulikakos P., Rafailidis P.I., Tansarli G.S. Antibiotic treatment of infections due to carbapenem-resistant Enterobacteriaceae: systematic evaluation of the available evidence. Antimicrob Agents Chemother 2014; 58(2): 654-663, doi: 10.1128/AAC.01222-13
18. Borges C.A., de Cássia de Andrade M.R., Vieira M.A., Souza L.A. C. Multidrug resistance genes, including blaKPC and blaCTX–M-2, among K. pneumoniae isolated in Recife, Brazil. Rev Soc Bras Med Trop 2012; 45(5): 572-578, doi: 10.1590/s0037-86822012000500007
19. Nordmann P., Poirel L., Walsh T.R., Livermore D.M. The emerging NDM carbapenemases. Trends Microbiol 2011; 19(12): 588-59, doi: 10.1016/j.tim.2011.09.005
20. Monaco M., Giani T., Raffone M., et al. Colistin resistance superimposed to endemic carbapenemresistant K. pneumoniae: a rapidly evolving problem in Italy, November 2013 to April 2014. Euro Surveill 2014; 19(42): 2093, doi: 10.2807/1560-7917.es2014.19.42.20939
21. Yamamoto M., Pop-Vicas A.E. Treatment for infections with carbapenem-resistant Enterobacteriaceae: what options do we still have? Critical Care 2014; 18(3): 229, doi: 10.1186/cc13949